温州医科大学成人高等教育
药学专升本
无机化学练习题
选择题
第一章 原子结构
1、在量子力学中,原子轨道的同义词是
A、电子云 B、波函数 C、概率 D、概率密度
2、下列原子中电负性最大的是
A、N B、O C、F D、Cl
3、元素原子的核外电子排布如下,其中元素电负性最大的是
A、1s22s22p63s23p63d104s24p64d105s25p4 B、1s22s22p63s23p63d104s24p5
C、1s22s22p63s23p63d104s24p64d105s25p66s1 D、1s22s22p63s23p63d104s24p64d105s2
4、有四种元素,其基态原子价层电子组态分别为
① 2s22p5 , ② 4s24p5, ③ 5s22p0, ④4s24p0 ,它们中电负性最大的是
A、① B、② C、③ D、④
5、假定某一电子有下列成套量子数(n、l、m、s),其中不可能存在的是
A、3,2,2,+1/2 B、3,1,-1,+1/2
C、l,0,0,-1/2 D、2,-1,0,+l/2
6、下列各组量子数的值没有错误的是
A、n = 1, l = 1, m = 0 B、n = 3, l = 3, m = 2
C、n = 0, l = 0, m = 0 D、n = 1, l = 0, m = 0
7、下列各组中,量子数不合理的是哪一组
A、2、2、2、![]() B、3、2、2、
B、3、2、2、![]() C、1、0、0、
C、1、0、0、![]() D、2、1、0、
D、2、1、0、![]()
8、下列四组量子数中,不合理的是(按n,l,m,s的顺序)
A、3,2,2,+1/2 B、3,1,-1,+1/2
C、2,2,0,+1/2 D、2,1,0,-1/2
9、下列各组量子数(n, l, m)不合理的是
A、2,1,0 B、2,1,-1 C、3,0,+1 D、4,3,3
10、基态24Cr 原子最外层电子的四个量子数只能是
A、4,1,0,+1/2 B、4,0,0,+1/2 C、4,.1,1,-1/2 D、3,0,0,-1/2
11、对于4p1电子,下列描述( n, l, m, s )正确的是
A、4, 1, -1, -1/2 B、4, 3, 2, 1
C、4, 2, -2, -1/2 D、4, 0, 0, +1/2
12、电子排布为[Ar]3d54s2者,可以表示
A、25Mn B、26Fe C、27Co D、28Ni
13、某元素最高能级组成电子构型 3d104s2,则该元素位于周期表
A、S区 B、p区 C、d 区 D、ds 区
14、元素原子的核外电子排布如下,不属于Ⅷ族元素的是
A、1s22s22p63s23p63d104s24p64d75s2 B、1s22s22p63s23p63d104s24p6
C、1s22s22p63s23p63d104s24p64d85s2 D、1s22s22p63s23p63d64s2
15、某金属离子M2+ 的价层电子组态为3d9,其在周期表中位置为
A、ⅧB族,d区,第三周期 B、ⅠB族,ds区,第三周期
C、ⅠB族,ds区,第四周期 D、ⅠA族,ds区,第四周期
16、某基态原子中的电子主量子数最大为3 ,则原子中
A、仅有s电子 B、仅有p电子
C、只有s、p电子 D、有s、p、d电子
17、在多电子原子中,决定电子能量的量子数为
A、n B、n和l C、n,l和m D、l
18、由n和l两个量子数可以确定
A、原子轨道 B、能级
C、电子运动的状态 D、电子云的形状和伸展方向
19、下列多电子原子能级在电子填充时能量最高的是
A、n = 1,l = 0 B、n = 2,l = 0
C、n = 4,l = 0 D、n = 3,l = 2
20、激发态的Be原子的电子排布式写成1s1 2s 3 ,可以看出这种写法
A、是正确的 B、违背了能量最低原理
C、违背了Pauli不相容原理 D、违背了Hund规则
21、H原子中3d、4s、4p能级之间的能量高低关系为
A、3d<4s<4p B、3d<4s=4p C、3d=4s=4p D、3d>4s=4p
22、量子数n = 3,m = 0的轨道,可允许的最多电子数为
A、6 B、2 C、9 D、18
23、下列离子中单电子数最少的是
A、26Fe3+ B、26Fe2+ C、27Co3+ D、28Ni2+
24、电子排布为[Ar]3d64s0者,可以表示
A、25Mn2+ B、26Fe3+ C、27Co3+ D、28Ni2+
25、决定原子轨道在空间的伸展方向的量子数是。
A、n B、l C、m D、s
26、已知某元素的价电子构型为3d64s2,则其原子序数为
A、20 B、 12 C、 26 D、 27
27、已知某原子核外的四个电子的量子数如下,其中电子能量最高的是
A、 (3,1,1,+1/2) B、 (2,1,1, +1/2)
C、 (2,1,0, +1/2) D、 (3,2,1,+1/2)
28、下列原子的电子排布中,违背了泡利不相容原理的是。
A、1s22s32p1 B、1s22p1 C、1s22s22px22py1 D、[Ar]3d44s2
29、某原子的基态电子组态是[Kr]4d105s25p1,该元素的价层电子是
A、4d105s25p1 B、5s25p1 C、5p1 D、4d10
30、在多电子原子中,下列哪个轨道具有最高的能量
A、 2s B、 2p C、 3s D、 3p
31、表示原子轨道角度分布的函数是
A、Rn, l(r) B、 Yl , m (θ,φ)
C、 R2n, l(r) D、 Y2l , m (θ,φ)
32、下列各组描述电子运动状态的四个量子数中,合理的是
A、 4,3,2,0 B、 5,4,3,+1/2
C、 3,3,-1,+1/2 D、 4,0,1/2,+1/2
33、某离子M3+的电子排布式为[Ar]d6,则该元素属于( )族。
A、ⅢA B、0 C、Ⅷ D、ⅢB
34、决定电子自旋方向的量子数是
A、 n B、 l C、 m D、 s
参考答案:
1、B 2、C 3、B 4、A 5、A 6、D 7、A 8、C 9、C 10、B
11、A 12、A 13、D 14、B 15、C 16、C 17、B 18、B
19、D 20、C 21、B 22、B 23、A 24、C 25、C 26、C
27、D 28、A 29、B 30、D 31、B 32、B 33、C 34、D
第二章 分子结构
1、水具有反常的高沸点是存在着
A、氢键 B、取向力 C、共价键 D、孤电子对
2、NH3的沸点高于PH3,是由于存在着
A、共价键 B、分子间氢键 C、离子键 D、分子内氢键
3、下列液态物质同时存在取向力、诱导力、色散力和氢键的是
A、NH3 B、CH3Cl C、HCl D、CHCl3
4、CH3CH2OH和H2O分子之间存在的作用力形式是
A、色散力 B、色散力、诱导力
C、色散力、诱导力、取向力 D、色散力、诱导力、取向力、氢鍵
5、下列各组分子间同时存在取向力、诱导力、色散力和氢键的是
A、N2 和 CCl4 B、CHCl3 和 CH4 C、H2O 和 CH3OH D、H2S 和 BCl3
6、下列分子键角最小的是
A、H2S B、CO2 C、CCl4 D、BF3
7、下列分子中,偶极距不等于零的分子是
A、BeCl2 B、PCl3 C、PCl5 D、SiF4
8、下列分子属于非极性分子的是
A、NH3 B、CO2 C、NO2 D、SO2
9、CH3Cl分子中C和Cl 间σ键采用何种轨道重叠
A、C的px轨道与Cl的px轨道 B、C的sp杂化轨道与Cl的p轨道
C、C的sp2杂化轨道与Cl的p轨道 D、C的sp3杂化轨道与Cl的p轨道
10、形成BF3、CO2、H2O的ơ键的原子轨道和杂化轨道是不同的,下列顺序符合上述物质成键轨道的是
A、sp3-p、sp3-s、sp2-p B、sp-p、sp-p、sp-p
C、sp3-s、sp-p、sp2-p D、sp2-p、sp-p、sp3-s
11、在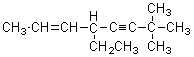 分子中,
分子中,![]() 键的数目是
键的数目是
A、3个 B、4个 C、5个 D、6个
12、根据杂化轨道理论,H2O分子的杂化方式是
A、sp等性杂化 B、sp2 不等性杂 C、sp3等性杂化 D、sp3 不等性杂化
13、根据杂化轨道理论,H2S分子的杂化方式是
A、sp等性杂化 B、sp2 不等性杂化 C、sp3等性杂化 D、sp3 不等性杂化
14、下列分子中,其中心原子均采用不等性s p 3 杂化的一组是
A、H2O,NH3,H2S B、BF3,NH3,CH4
C、PH3,CO2,H2S D、BF3,CH4,SnCl4
15、H2O是V字型(弯曲形)分子,其中氧原子实行
A、sp3杂化 B、不等性sp3杂化 C、sp2杂化 D、sp杂化
16、下列说法正确的是
A、取向力只存在于极性分子之间
B、色散力只存在于非极性分子之间
C、凡有氢键的物质其熔、沸点都一定比同类物质的熔沸点高
D、在所有含氢化合物的分子间都存在氢键
17、下列分子中,同时存在![]() 键和
键和![]() 键的是
键的是
A、CH4 B、HCl C、Cl2 D、N2
18、下列各组分子之间只存在着色散力的是
A、 甲醇和水 B、 溴化氢和氯化氢
C、 氮气和水 D、 苯和四氯化碳
19、下列关于氢键的描述,错误的是
A、氢键是一种较弱的有方向性和饱和性的化学键
B、氢键可分为分子间氢键和分子内氢键
C、氢键的作用力与分子间作用力相近
D、氢键的形成将对物质的某些物理性质产生影响
20、甲醇和水之间存在的分子间作用力是
A、Vander Waals 力 B、氢键 C、 化学键 D、A 和B
21、下列说法中正确的是
A、由同种元素组成的双原子分子,一定是非极性分子
B、由同种元素组成的多原子分子,一定是非极性分子
C、由极性键构成的分子一定是极性分子
D、非极性分子中的化学键一定都是非极性键
22、下列分子中键角最小的是
A、HgCl2 B、BCl3 C、NH3 D、H2O
23、下列分子中,含有配位键的是
A、H2O B、NH4Cl C、NH3 D、C2H5OH
24、下列说法错误的是。
A、NH4Cl分子中含有离子键,共价键和配位键
B、氢键是化学键
C、HNO3分子中存在分子内氢键
D、任何共价键形成的化合物分子间都存在色散力
25、下列化学键中,极性最强的是
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
26、下列分子中极性分子是
A、CH3Cl B、CH4 C、CH2CH2 D、BF3
27、下列哪些轨道重叠形成σ键
A、 s—s B、 s—px C、 px—px D、 三者都可以
28、关于杂化轨道理论,下列说法错误的是
A、 杂化轨道是由不同原子的外层能量相近的原子轨道组合而成
B、 有几个原子轨道参加杂化,就形成几个杂化轨道
C、 杂化轨道比杂化前的原子轨道成键能力强
D、 不同类型的杂化轨道间的夹角不同
29、下列分子或离子中,键角最小的是
A、NH4+ B、 SO42- C、BF3 D、H2O
30、氮分子中的化学键是
A、 3 个σ键 B、 1 个σ键、2 个π键
C、 2 个σ键,1 个π键 D、 3 个π键
参考答案:
1、A 2、B 3、A 4、D 5、C 6、A 7、B 8、B 9、D 10、D
11、B 12、D 13、D 14、A 15、B 16、B 17、D 18、D
19、A 20、D 21、A 22、D 23、B 24、B 25、A 26、A
27、D 28、A 29、D 30、B
第三章 溶解与沉淀 第四章 酸与碱
1、弱酸性药物在酸性环境中比在碱性环境中
A、解离度高 B、解离度低 C、极性大 D、不变
2、醋酸在液氨和在水中分别是
A、弱酸和强碱 B、强酸和强碱 C、强酸和弱酸 D、弱酸和弱碱
3、298.15K时,HAc的Ka = 1.76×10-5,NH3·H2O的Kb = 1.79×10-5,则在该温度下,NaAc溶液的碱性和NH3·H2O相比
A、比NH3·H2O强 B、比NH3·H2O弱
C、两者相当 D、不好比较
4、用0.1 mol·L-1 NaOH 溶液分别与HCl和HAc溶液各20ml 反应时,均消耗掉20ml NaOH,这表示
A、HCl和HAc溶液中,H+浓度相等 B、HCl和HAc溶液的物质的量浓度相等
C、HCl和HAc溶液的pH 相等 D、HCl和HAc的质量浓度相等
5、在HAc溶液中加入下列哪种物质时,可使HAc的解离度减小、pH值增大
A、NaAc B、NaOH C、HCl D、H2O
6、若使HAc的解离度和溶液pH均减小,可向HAc溶液中加入
A、NaOH B、HCl C、H2O D、NaAc
7、在弱电解质HB溶液中,加入固体NaB(可溶于水),则HB溶液的
A、 解离度↗,[H+]↘ B、 解离度↘, [H+]↗
C、 解离度↘,[OH-]值↘ D、 解离度↘,[OH-]值↗
8、在弱电解质HB溶液中,加入等体积的蒸馏水,则HB溶液的( )
A、离解度↘, [H+]↗ A、离解度↘,[0H-]值↗
C、离解度↘,[0H-]值↘ D、离解度↗,[H+]↘
9、313K时,水的Kwy =3.8×10-14;在313K时,pH=7的溶液为
A、中性 B、酸性 C、碱性 D、缓冲溶液
10、按照酸碱质子理论,HPO42-的共轭碱是
A、PO43- B、H2PO4- C、H3PO4 D、OH-
11、下列各组分子离子中,不属于共轭关系的是
A、HCl-Cl- B、H2CO3-CO32- C、H2CO3-HCO3- D、NH4+-NH3
12、H2PO4-的共轭碱是
A、HPO42- B、OH- C、PO43- D、H3PO4
13、H2PO4-的共轭酸是
A、H3PO4 A、HPO42- C、PO43- D、上述三种均正确
14、在下列各对物质中,属于共轭酸碱对的是
A、H3PO4、HPO43- B、H2S、S2-
C、H2O、H2 D、NH2- 、NH2-
15、0.1mol·L-1NaOH和0.1mol·L-1 NH3H2O等体积混合,溶液中总的[OH-] /(mol·L-1 ) 为
A、0.1013 B、0.1 C、0.05 D、0.052
16、在H2S的Ka1、Ka2 表示式中的[H+]是
A、Ka1中的大 B、Ka2中的大 C、Ka1、Ka2 中的一样大 D 不能确定
17、0.1 mol•L-1的NaF 溶液的pH 为 (HF 的Ka = 3.5 ×10-4)
A、11.84 B、2.46 C、5.77 D、8.23
18、0.100 mol · L-1的NH4Cl溶液的pH值为(NH3的Kb = 1.79×10-5)
A、11.12 B、2.87 C、5.12 D、8.88
19、人体血浆中最重要的抗酸成分是
A、H2PO4- B、HPO42- C、HCO3-; D、CO2
20、影响缓冲容量的因素是
A、缓冲溶液的p H值和缓冲比
B、共轭酸的pKa和共轭碱的pKb
C、缓冲溶液的共轭碱浓度与共轭酸浓度及二者之比
D、缓冲溶液的总浓度和共轭酸的pKa
21、下列各物质之间能构成缓冲系的是
A、NaHSO4和Na2SO4 B、HCl和HAc
C、NaH2PO4和Na2HPO4 D、NH4Cl和NH4Ac
22、以下各组溶液中,哪组不是缓冲溶液
A、0.2 mol·L-1 NH4Cl与0.1 mol·L-1 NaOH等体积混合
B、0.1 mol·L-1NaOH与0.1 mol·L-1HAc等体积混合
C、0.1 mol·L-1NaOH与0.2 mol·L-1HAc等体积混合
D、0.1 mol·L-1NaOH与0.2 mol·L-1Na2HPO4等体积混合
23、下列各组溶液中,不能成为缓冲溶液的是
A、Na2HPO4与Na3 PO4混合液 B、NH4Cl与NH3·H2O混合液
C、0.2mol·L-1.NaAc 与0.1mol·L-1HCl混合液
D、0.1mol·L-1NaOH 与0.1mol·L-1HAc等体积混合液
24、下列各组等体积混合的溶液,无缓冲作用的是
A、0.1 mol·L-1HCl和0.2 mol·L-1 NH3·H2O
B、0.1 mol·L-1HAc和0.001 mol·L-1NaAc
C、0.2 mol·L-1KH2PO4和0.2 mol·L-1Na2HPO4
D、0.1 mol·L-1NaOH和0.2 mol·L-1HAc
25、下列公式中有错误的是
A、pH= pKa +lg[HB]/[B-] B、pH= p Ka -lg[HB]/[B-]
C、pH= p Ka +lg n(B-)/n(HB) D、pH= -lg(Kw/Kb)+lg[B-]/[HB]
26、已知NH3水的pKby = 4.75,H2CO3的pKa1y = 6.38、pKa2y =10.25,欲配制pH = 9.00的缓冲溶液,可选择的缓冲对是
A、NH3-NH4Cl B、H2CO3-NaHCO3 C、NaHCO3-Na2CO3 D、H2CO3-Na2CO3
27、HAc的Ka=1.76×10-5,欲配制pH=4.50的缓冲溶液,若用HAc及NaAc配制,则二者的浓度比cNaAc / cHAc为
A、等于1 B、大于1 C、大于2 D、小于1
28、由0.1mol·L-1 H3PO4与0.1mol·L-1 NaOH配制pH=2.16的缓冲溶液,则其体积比为(已知H3PO4的pKa1=2.16,pKa2=7.21,pKa3=12.32)
A、 2:1 B、 1:1 C、 1:2 D、 1:3
29、NH3·H2O的pKb=4.75,在20.0 mL0.10 mol·L-1NH3·H2O溶液中,加入20.0 mL 0.050 mol·L-1HCl,则溶液中的pH为
A、4.75 B、7 C、9.25 D、9.55
30、六次甲基四胺[(CH2)6N4] (Kb=1.0×10-9)及其强酸盐[(CH2)6N4H] +组成的缓冲溶液的缓冲范围的pH为
A、4~6 B、6~8 C、8~10 D、9~11
31、下列溶液中能与0.10 mol×L-1NaHCO3等体积混合配成缓冲溶液的是
A、0.10 mol×L-1HCl B、0.10 mol×L-1KOH
C、0.05 mol×L-1H2SO4 D、0.05mol×L-1NaOH
32、将0.2 mol·L-1 HAc溶液55.0 mL 与0.2 mol·L-1NaOH溶液5.0 mL混合,则混合溶液的pH为多少?(HAc的pKa=4.75)
A、8.88 B、7 C、3.75 D、1.77
33、298K时,Mg(OH)2在水中溶解度/(mol·L-1)是[已知Mg(OH)2 的Ksp 为5.61´10-12]
A、1.77´10-4 B、1.12´10-4 C、2.36´10-6 D、1.12´10-6
34、Ag2CrO4的溶解度为S mol·L-1,则它的Ksp为
A、S 2 B、4S 3 C、27 S 4 D、108 S 5
35、CaF2饱和溶液的浓度为2´10-4 mol·L-1,则CaF2的溶度积为
A、8´10-4 B、4´10-4 C、8´10-8 D、3.2´10-11
36、某难溶强电解质AB2,在水溶液中[B] = xmol·L-1,则AB2的Ksp为
A、x3/2 B、x3 C、2x3 D、4x3
37、难溶强电解质A2B在水溶液中达到溶解平衡时,[A+] = x mol•L-1,[B2+]= y mol•L-1,则下列等式中正确的是
A、Kspy = x2y B、Kspy =1/2 x2y C、Kspy =4 x2y D、Kspy = xy
38、AgI在0.010 mol·L-1 KI溶液中的溶解度为(已知AgI的KSP=9.3×10-17)
A、9.3×10-15 mol·L-1 B、9.3×10-15g·(100mL)-1
C、9.6×10-9 mol·L-1 D、9.6×10-9 g·(100mL)-1
39、CaCO3在下列哪种溶液中,溶解度较大
A、H2O B、Na2CO3 C、KNO3 D、CaCl2
40、在有AgCl固体存在的AgCl饱和溶液中,当加入等体积的下列溶液时,能使AgCl的溶解度增大的是
A、AgCl饱和溶液 B、1mol•L-1NaCl溶液
C、1mol•L-1AgNO3溶液 D、1mol•L-1NaNO3溶液
41、BaSO4在下列溶液中溶解度最大的是
A、1mol×L-1 NaCl B、1mol×L-1 H2SO4 C、2mol×L-1 BaCl2 D、纯水
42、在纯水和浓度都是0.1mol·L-1的下列电解质溶液中
(1) NaNO3 (2) NaI (3) Cu(NO3)2 (4) NaBr (5) H2O
AgBr(s)溶解度递增的次序为
A、 (1)<(2)<(3)<(4)<(5) B、 (4)<(5)<(2)<(1)<(3)
C、 (5)<(2)<(4)<(1)<(3) D、 (4)<(5)<(1)<(3)<(2)
43、25℃时,AgCl的Ksp=1.0×10-10,如果向AgCl饱和溶液中滴加浓HCl溶液,当溶液中Ag+离子浓度降为1.0×10-8mol·L-1时,溶液的pH为
A、1.0 B、2.0 C、3.0 D、7.0
44、AgCl在下列溶液中溶解度最大的是
A、0.1 mol/L NaCl B、0.1 mol/LHCl
C、0.1 mol/L NaNO3 D、纯水
45、已知HCN的Ka=5.0×10-10,则CN-的Kb等于
A、2.0×10-10 B、5.0×10-10 C、2.0×10-5 D、2.2×10-10
46、按质子论观点,下列几种对NH4Ac水溶液的描述中,正确的是
A、它是酸 B、它是碱
C、它是两性物质 D、以上说法都不正确
47、根据酸碱质子理论, 下列物质既可作酸又可作碱的是
A、PO43- B、NH4+ C、H2O D、H3O+
48、某难溶电解质M2X,其溶度积为Ksp,则其溶解度S 的近似表示式是
A、S=Ksp1/2 B、S=(Ksp/4)1/3 C、S=(Ksp/2)1/3 D、S=(Ksp)1/3
49、0.1 mol·L-1 HA溶液(Ka=1.0×10-5)的pH为
A、2.0 B、2.5 C、3.0 D、4.0
50、HSO3-的共轭酸为
A、H2SO3+ B、H2SO3 C、SO32- D、H2SO4
51、在纯水中,加入一些酸,则溶液中
A、[H+]与 [OH-]乘积变大 B、[H+]与 [OH-]乘积变小
C、[H+]与 [OH-]乘积不变 D、 [H+]等于[OH-]
52、85℃时,纯水的pH为6.5,则其pOH应为
A、7.5 B、6.5 C、7 D、小于6.5
53、在NH3的水解平衡NH3 +H2O= NH4+ +OH-中,为使[OH-]增大,可行的方法是
A、加H2O B、加NH4C1 C、加HAc D、加NaC1
54、使HCN 溶液离解度降低的被加物质是
A、 NaCN B、 NaCl C、 NaOH D、 H2O
55、含有大量固体BaS 的饱和溶液中, 加少量( )物质对其溶解度无影响.
A、 Na2S B、KCl C、H2O D、BaCl2
56、在0.1mol·L-1的NH3 ·H2O溶液中,加入一些NH4C1固体,则
A、NH3的Kb增大 B、NH3的Kb减少
C、溶液pH增大 D、溶液pH减少
57、根据酸碱质子理论,下列叙述中不正确的是
A、水溶液中的酸碱离解反应,水解反应及中和反应三者都是质子转移反应
B、不存在盐的概念
C、强酸反应后变成弱碱
D、酸越强,其共轭碱也越强
58、在水溶液中属于二元弱碱的是
A、NH4C1 B、NaHCO3 C、Na2CO3 D、Na2SO4
59、按酸碱的质子理论,下列物质中属于两性物质的有。
① H2O ②NH4+ ③ NaHCO3 ④ Ac-
A、①②③ B、①③ C、②④ D、④
60、将同浓度的HAc 与NaOH 溶液等体积混合,溶液显
A、酸性 B、碱性 C、中性 D、两性
61、在酸碱反应中:H2PO4-+H2O = H3O+ +HPO42-属于酸的是
A、HPO42-和H3O+ B、H2PO4-和H3O+
C、H2PO4-和HPO42- D、H3O+和H2O
62、室温下0.10mol .L-1 HB 的pH 值为3.0,则0.10mol .L-1 NaB 溶液的pH 值为
A、 12.0 B、 10.0 C、 9.0 D、 8.0
参考答案:
1、B 2、C 3、D 4、B 5、A 6、B 7、D 8、D 9、C 10、A
11、B 12、A 13、A 14、D 15、C 16、C 17、D 18、C
19、C 20、C 21、C 22、B 23、D 24、B 25、A 26、A
27、D 28、A 29、C 30、A 31、D 32、C 33、B 34、B 35、D 36、A 37、A 38、A 39、C 40、D 41、A 42、D 43、B 44、C 45、C 46、C 47、C 48、B 49、C 50、B 51、C 52、B 53、D 54、A 55、C 56、D 57、D 58、C 59、B 60、B 61、B 62、C
第五章 氧化还原
1、下列说法中错误的是
A、原电池正极发生还原反应,负极发生氧化反应
B、原电池中氧化剂在原电池的正极
C、原电池的电池反应就是作为氧化剂的物质同作为还原剂的物质起反应
D、原电池中,电极电位较低的电对组成电池的正极
2、依次进行下列实验:FeCl3溶液加入KI溶液会析出I2,FeSO4溶液能使溴水褪色,溴化钾溶液能使酸性K2Cr2O7溶液从红色转变为绿色。由此可知,在下列物质中,最强的氧化剂是
A、Br2 B、Fe3+ C、I2 D、Cr2O72-(酸性溶液)
3、已知jy (Fe3+/Fe2+)= 0.77V;jy (Fe2+/Fe)=-0.41V;jy (Sn4+/Sn2+) = 0.15V;jy (Sn2+/Sn) = -0.14V;在标准状态下,这几种物质中相对最强的氧化剂和相对最强的还原剂是
A、Fe3+ ,Sn B、Sn4+ ,Sn2+ C、Fe3+ ,Fe D、Sn4+ ,Fe
4、已知 j y (Pb2+/Pb) = -0.1263V;j y (Cr3+/Cr2+) = -0.407V;j y (Fe3+/Fe2+) = 0.771V;在标准状态下最强的氧化剂和最强的还原剂分别是
A、Fe3+和Cr2+ B、Cr3+和Fe2+ C、Fe3+和Pb D、Cr3+和Fe2+
5、将银丝插入1L的下列溶液中组成电极,则电极电位最低的是
A、含AgNO30.1mol B、含AgNO30.1mol,含NaI0.1mol
C、含AgNO30.1mol,含NaCl0.1mol D、含AgNO30.1mol,含NaBr0.1mol
6、已知φy (Cl2/Cl-) = 1.358V;φy (Hg2+/Hg22+) = 0.905V;φy (Fe3+/Fe2+) = 0.771V;φy (Zn2+/Zn) = -0.762V,则在标准状态下最强的氧化剂和最强的还原剂分别是
A、Fe3+和Cl- B、Fe3+和Zn C、Hg2+和Fe2+ D、Cl2和Zn
7、今有电池:(-)Pt│Cr2O72-,H+,Cr3+‖Cl-│Cl2(g),Pt(+),要增加电池电动势的办法是
A、增加[H+] B、增加Cl2气分压 C、增加[Cl-] D、增加[Cr2O72-]
8、今有电池:(-)Pt,H2(g)∣H+‖Cu+∣Cu(+),要增加电池电动势的办法是
A、负极加大[H+] B、负极降低H2气分压
C、正极加大[Cu+] D、正极加入氨水
9、在原电池反应H2O2+2Fe2++2H+=2H2O+2Fe3+系统中提高酸的浓度,原电池电动势E会
A、增大 B、减小 C、不变 D、无法确定
10、电极电位与pH无关的电对是
A、H2O2/H2O B、IO3-/I- C、MnO2 /Mn2+ D、MnO4-/MnO42-
11、下列反应中,不属于氧化还原反应的是
A、SnCl2 + 2FeCl3 ![]() SnCl4 + 2FeCl2
SnCl4 + 2FeCl2
B、Cl2 + 2NaOH ![]() NaClO + NaCl + H2O
NaClO + NaCl + H2O
C、K2Cr2O7 + 2KOH ![]() 2K2CrO4 + H2O
2K2CrO4 + H2O
D、Zn + CuSO4 ![]() ZnSO4 + Cu
ZnSO4 + Cu
12、对于电池反应Cu2++Zn=Cu+Zn2+,下列说法正确的是。
A、当c(Cu2+)=c(Zn2+)时,反应达到平衡
B、当j y (Cu2+/Cu)= j y (Zn2+/Zn)时,反应达到平衡
C、当j (Cu2+/Cu)= j (Zn2+/Zn)时,反应达到平衡
D、当原电池的标准电动势等于零时,反应达到平衡
13、下列反应中,Fe2+作为氧化剂的是
A、 Ag+ + Fe2+ ![]() Ag↓+ Fe3+
Ag↓+ Fe3+
B、 Zn + Fe2+ ![]() Zn2+ + Fe
Zn2+ + Fe
C、 Fe2+ + S2- ![]() FeS↓
FeS↓
D、 2Fe2+ + H2O2 + 2H+ ![]() 2Fe3+ + 2H2O
2Fe3+ + 2H2O
14、已知j y(Fe3+/Fe2+) = 0.77 V,j y(Cu2+/Cu) = 0.34 V,j y(Sn4+/Sn2+)=0.15 V,
j y(Fe2+/Fe)= - 0.44 V,在标准状态下,下列反应能正向进行的是
A、2Fe3+ + Cu = 2Fe2+ + Cu2+
B、Sn4+ + Cu = Sn2+ + Cu2+
C、Cu + Fe2+ = Cu2+ + Fe
D、Sn4+ + 2Fe = Sn2+ + 2Fe3+
15、设pH 由0 到5,下列电对中电极电位改变最大的是。
A、 MnO4-/Mn2+ B、 Cr2O72-/Cr3+ C、 BrO3-/Br- D、 O2/H2O2
16、已知
电对 |
jy/V |
Cl2/Cl- |
1.3583 |
Hg2+/Hg22+ |
0.905 |
Fe3+/Fe2+ |
0.771 |
Zn2+/Zn |
-0.7618 |
在标准状态下,可能发生氧化还原反应的一对物质是
A、Fe3+和Cl- B、Fe3+和Hg22+ C、Zn和Fe3+ D、 Zn2+和Fe2+
17、将金属Pt插入FeCl3和FeCl2溶液中所组成的电极属于
A、金属电极 B、金属一金属难溶盐电极
C、氧化还原电极 D、气体电极
18、已知电池组成式中,左电极和右电极的标准电极电势分别为-0.403 V和 +0.345 V ,电池的标准电动势为
A、-0.058 V B、-0.748 V C、0.748 V D、0.058 V
19、下列半反应式的配平系数从左到右依次为 NO3-+H++e→NO+H2O
A、1,3,4,2,1 B、2,4,3,2,1 C、1,6,5,1,3 D、1,4,3,1,2
20、下列说法中正确的是
A、将反应Cr2O72-+14H++6Cl-=2Cr3++3Cl2+7H 2O组成原电池,可表示为(-)Pt(s)|Cr2O72-(c1), Cr3+(c2), H+(c3)‖Cl-(c4)|Cl2(p) ,Pt(s)(+)
B、K2Cr2O7的氧化能力通常随pH增大而增大。
C、电位法测定溶液pH时,指示电极与参比电极的j 值随溶液的pH值改变而改变。
D、两个电对组成原电池,其中标准电极电势较高者一定为原电池的正极。
21、把氧化还原反应Zn + 2Ag+ ![]() Zn2+ + 2Ag 组成原电池,欲使该原电池的电动势增大,可采取的措施是
Zn2+ + 2Ag 组成原电池,欲使该原电池的电动势增大,可采取的措施是
A、 降低Zn2+浓度 B、 降低Ag+浓度
C、 增加Zn2+浓度 D、 加大Ag电极的表面积
22、Co3+与[Co(CN)6]3-的氧化能力的关系是
A、Co3+ =[Co(CN)6]3- B、Co3+>[Co(CN)6]3-
C、Co3+<[Co(CN)6]3- D、以上说法都不正确
23、增加电池 (-) Cu︱Cu2+‖Ag+︱Ag (+)电动势的方法是
A、正极加入氨水 B、负极加氨水
C、正极加NaCl D、正极加NaBr
24、已知300 K时,2.303RT/F = 0.060V,则氧化还原反应
Pb(s) + Sn2+(aq) ![]() Pb2+(aq) + Sn(s) 在300 K时的标准平衡常数与两个电对的标准电极电势之间的定量关系为
Pb2+(aq) + Sn(s) 在300 K时的标准平衡常数与两个电对的标准电极电势之间的定量关系为
A、 lg![]() =
= ![]()
B、 lg![]() =
= ![]()
C、 lg![]() =
= ![]()
D、lg![]() =
= ![]()
25、能满足j y ( (Cl2/Cl-)= +1.30V 的电极反应式是
A、Cl2+2e=2Cl- B、2Cl--2e= Cl2
C、1/2Cl2+e=Cl- D、 上述所有反应式
26、下列关于氧化值的叙述中,不正确的是
A、单质的氧化值为0 B、氧气的氧化值为-2
C、在多原子分子中, 各元素原子的氧化值的代数和等于0
D、氧化值可以是整数或分数
27、其他条件不变时,能使电对MnO4-/Mn2+的电极电位增大的方法是
A、增大pH B、降低pH C、增大Mn2+浓度 D、前三个都可以
参考答案:
1、D 2、D 3、C 4、A 5、B 6、D 7、B 8、C 9、A 10、D
11、C 12、C 13、B 14、A 15、B 16、C 17、C 18、C 19、D 20、B 21、A 22、B 23、B 24、A 25、D 26、B 27、B
第六章 配位化合物
1、 [Fe(C2O4)2(NH3)2]- 中,Fe3+中心离子的配位数是
A、3 B、4 C、 5 D、 6
2、已知0.1 mol · L-1 的Co(NH3)4Cl3溶液与36g · L-1葡萄糖(C6H12O6,Mr=180)等渗,则该配合物中心原子的配位数是
A、2 B、4 C、6 D、8
3、Point out the coordination number and the oxidation number of the central atom in coordination compound [Co(H2NCH2CH2NH2)2(NO2)Cl]Cl
A、4,Ⅱ B、6,Ⅱ C、6,Ⅲ D、4,Ⅲ
4、[Co(C2O4)2(en)]- 中,Co3+离子配位数是
A、3 B、4 C、5 D、 6
5、下列配合物中配位数是6的是
A、[Cu(NH3)4]2+ B、[Ag(NH3)2]+ C、[Pt(NH3)2Cl2] D、[FeEDTA] -
6、若使AgBr溶于水中,可以加入
A、H2O B、AgNO3 C、Na2(S2O3)2 D、NaOH
7、下列配合物的命名中错误的是
A、[Co(ONO)(NH3)5]SO4 硫酸亚一(硝酸根)·五氨合钴(Ⅲ)
B、[PtNH2(NO2)(NH3)2] 一氨基·一硝基·二氨合铂(Ⅱ)
C、NH4[Co(NO2)4(NH3)2] 四硝基·二氨合钴(Ⅲ)酸铵
D、[Co(NH3)2(en)2]Cl3 氯化二(乙二胺)·二氨合钴(Ⅲ)
8、下列试剂中能与中心原子形成五员环结构螯合物的是
A、C2O42- B、CH3NH2
C、H2NCH2CH2CH2NH2 D、-OOCCH2COO-
9、下列化合物中,能与中心原子形成六元环螯合物的是
A、CH3NH2 B、CH3CH2NH2
C、H2NCH2CH2NH2 D、H2NCH2CH2CH2NH2
10、下列配体中,何种配体是螯合剂
A、NH3 B、Cl- C、H2N-NH2 D、EDTA
11、下列化合物中,能与中心原子形成五元环螯合物的是
A、CH3NH2 B、CH3CH2NH2
C、H2NCH2CH2NH2 D、H2NCH2CH2CH2NH2
12、下列化合物可作为螯合剂的是
A、H2N-NH2 B、H2N-CH2CH2COOH C、H2N-OH D、HO-OH
13、配合物[Pt(NH3)2Cl2]中的配位体是
A、NH3、Cl2 B、NH3、Cl- C、NH3 D、 Cl-
14、抗癌药物[Pt (NH3)2 Cl2] 空间构型为平面四方形,其中心离子杂化轨道方式为
A、dsp2 B、 sp3 C、 不等性sp3 D、 d2sp3
15、中心原子进行何种杂化,能与配体形成八面体构型的配合物
A、sp2 B、 d2sp3 C、 dsp2 D、 sp3
16、[27Co(NH3)6]3+属内轨型配离子,其中心离子的杂化类型为
A、dsp2 B、sp3 C、d2sp3 D、sp3d2
17、已知配离子[28Ni(H2O)4]2+为顺磁性物质,则该配离子是
A、内轨配合物 dsp2杂化 B、外轨形配合物 sp3杂化
C、外轨形配合物 sp3d2杂化 D、内轨配合物 d2sp3杂化
18、有下列原子序数的二价离子,只能形成外轨型配合物的是
A、26 B、27 C、28 D、30
19、下列配离子中,属于内轨型配合物的是
A、[Ag(CN)2] –(直线型) B、[Zn(NH3)4] 2+ (四面体型)
C、[Ni(CN)4] 2– (平面四边形) D、[Ni(NH3)4] 2+(四面体型)
20、配离子[Fe(CN)6]3-,采取的是d2sp3杂化形式,则此配合物的空间构型为
A、正四面体 B、正八面体 C、三角双锥 D、平面三角形
21、测得配位数为6的Fe3+离子配合物的磁距μ=2.13 μB,则单电子数为
A、1个单电子,内轨配合物 B、2个单电子,内轨配合物
C、1个单电子,外轨配合物 D、2个单电子,外轨配合物
22、关于配离子[CoF6]3-,下列说法不正确的是
A、具有顺磁性 B、中心原子是Co3+
C、空间构型为正八面体 D、属于螯合物
23、已知AgCl的溶度积常数为Ksp,[Ag(NH3)2]+的稳定常数为Ks,则反应
AgCl(s) + 2 NH3 = [Ag(NH3)2]+ + Cl-的平衡常数![]() 为
为
A、KsKsp B、 1/ KsKsp C、Ks/Ksp D、Ksp/Ks
24、利用生成配合物使难溶电解质溶解时,下面哪种情况最有利于沉淀溶解
A、lgKs愈大,Ksp愈大 B、 lgKs愈小,Ksp愈大
C、lgKs愈大,Ksp愈小 D、lgKs愈小,Ksp愈小
25、已知AgCl的lgKsp= -11,[Ag(NH3)2] +的lgKs = 7。将 AgCl投入氨水进行溶解:AgCl(s) + 2NH3 = [Ag(NH3)2] + + Cl- ,达到溶解平衡时游离NH3的浓度为0.10 mol·L-1,求溶液中[Ag(NH3)2] +的浓度。
A、0.05 mol·L-1 B、0.01 mol·L-1 C、0.1mol·L-1 D、0.001mol·L-1
26、配合物[Co(ONO)(NH3)5]SO4,配体是
A、 NO2-、NH3 B、 ONO-、NH3
C、 NO2-、NH3、SO42- D、NH3、SO42-
27、配合物中的中心原子的轨道杂化时,其轨道必须是
A、含有成单电子的轨道 B、空轨道
C、已有配对电子的轨道 D、以上轨道均可
28、对Ks的正确描述是
A、配离子的Ks值愈大,配离子愈不稳定
B、可利用Ks值直接比较同种类型配离子的稳定性
C、一般来说,Ks值与温度有关,而与配离子的种类、配体的种类无关
D、Ks值的倒数值愈大,配离子愈稳定
29、0.01mol氯化铬( CrCl3·6H2O )在水溶液中用过量AgNO3处理,产生0.02molAgCl沉淀,此氯化铬最可能为
A、 [Cr(H2O)6]Cl3 B、 [Cr(H2O)5Cl]Cl2·H2O
C、 [Cr(H2O)4Cl2]Cl·2H2O D、 [Cr(H2O)3Cl3]·3H2O
30、下列配体中,属于多齿配体的是
A、 Br - B、 H2O C、 NH3 D、 en
31、相同条件下,下列配离子中最稳定的是
A、[Cu(NH3)4]2+ B、[Ag(NH3)2]+ C、[Cu(en)2]2+ D、[CaY]2-
32、EDTA与金属离子配位时,一分子的EDTA可提供的配位原子个数是
A、 2 B、 4 C、 6 D、 8
33、下列化合物中属于配合物的是
A、Na2S2O3 B、H2O2 C、C6H4Cl2 D、Ni(CO)4
参考答案:
1、D 2、C 3、C 4、D 5、D 6、C 7、D 8、D 9、D 10、D
11、C 12、B 13、B 14、A 15、B 16、C 17、B 18、D
19、C 20、B 21、C 22、D 23、A 24、A 25、D 26、B
27、B 28、B 29、B 30、D 31、D 32、C 33、D
第八、九章 元素部分
1、下列离子中,哪一个在加入Cl- 离子后,产生白色沉淀,继而再加入NH3·H2O后又变灰黑色的是:
A、Ag+ B、Pb2+ C、Hg22+ D、Hg2+
2、MnO4- 在中性介质(H2O)中与SO32-作用得到的产物是
A. MnO42- B. Mn2+ C. Mn D. MnO2
3、随着原子序数的递增,11号到17号元素的化学性质
A、金属性逐渐增强、非金属性逐渐减弱
B、金属性逐渐减弱、非金属性逐渐增强
C、碱性逐渐减弱、酸性逐渐增强
D、氧化性逐渐减弱、还原性逐渐增强
4、锰族元素的最高氧化数是
A、+4 B、+5 C、+6 D、+7
5、亚硫酸的性质较全面的叙述的是
A、只有酸性 B、只有氧化性
C、只有还原性 D、有酸性、氧化性和还原性
6、用KSCN溶液鉴定溶液中Fe3+离子的现象是
A、溶液变蓝色 B、溶液变橙色
C、溶液变红色 D、产生白色沉淀
7、实验室制取氯气时,剩余的氯气可以
A、排到空气中 B、用水吸收 C、用氢氧化钠溶液吸收 D、用食盐水吸收
8、卤亲单质的熔、沸点由高到低的顺序是
A、I2>Br2>C12>F2 B、Cl2>I2>Br2>F2
C、F2>C12>Br2>I2 D、C12>F2>Br 2>I2
9、铬族元素的最高氧化态是
A、+4 B、+5 C、+6 D、+7
10、+6价铬的化合物在酸性溶液中主要存在形式是
A、CrO42- B、Cr2O72- C、Cr6+ D、CrO2-
11、PbO2在酸性溶液中显
A、强还原性 B、强氧化性 C、既有氧化性又有还原性 D、中性
12、有关Cu+离子的叙述不正确的是
A、Cu+氧化能力强于Cu2+,在酸性溶液中Cu+易歧化
B、Cu+的配合物无未成对电子,都没有颜色
C、2Cu十 ↔ Cu+Cu2+,其平衡常数=106,所以Cu+的化合物在水溶液中很稳定。
D、Cu+必须形成难溶物或配合物才能稳定存在
13、卤化银中可溶的是
A、AgF B、AgCl C、AgBr D、AgI
14、把+3价铬化合物氧化为+6价铬化合物,选择的介质最好是
A、中性 B、碱性 C、酸性 D、任意
15、为了将含有K+、Zn2+、Fe3+的硫酸盐混和溶液里的Fe3+全部沉淀出来,应加入一种过量的试剂,以分离出只含Fe3+的一种沉淀物,这种试剂是
A、NH3·H2O B、Ba(OH)2 C、NaOH D、KSCN
16、MnO4-在酸性介质中的还原产物是
A、Mn B、Mn2+ C、MnO2 D、MnO42-
17、铂系元素中常用作抗癌药物的是
A、二茂铁 B、反铂 C、氯铂酸 D、顺铂
18、下列反应方程式不符合实验事实的是
A、2Ba2+ + Cr2O72- + H2O→ 2BaCrO4↓+ 2H+
B、Cu + 2H2SO4(浓) → CuSO4 + SO2 + 2H2O
C、Mn2++BiO3- + 2H+ → MnO2↓ + Bi3+ + H2O
D、Cu(OH)2 + 4NH3 →[Cu (NH3)4]2+ + 2OH-
19、配制SnCl2水溶液时,必须加入
A、足量的水 B、盐酸 C、碱 D、Cl2
20、在Cr2O72-溶液中加入Ag+,生成
A、Ag2 Cr2O7 B、Ag2CrO4 C、Ag2O D、AgOH
21、电负性最大的原子是
A、Cl B、K C、Na D、F
22、在NaH2PO4溶液中加入AgNO3溶液后主要产物是
A、 Ag2O B、 AgH2PO4 C、 Ag3PO4 D、 Ag2HPO4
23、加入KI溶液不会生成沉淀的是
A、 Cu2+ B、 Ag+ C、 Zn2+ D、 Hg2+
24、造成部分地区酸雨的主要大气污染物是
A、 CO2 B、 汽车排放的废气
C、 燃煤及冶炼厂排放的SO2 D、 石油化工厂排放的废气
25、某溶液与Cl-离子作用,生成白色沉淀,加氨水后变黑,则该溶液中可能存在的离子
A、 Pb2+ B、 Ag+ C、 Hg2+ D、Hg22+
26、下列有关卤素的论述,正确的是
A、溴是由Cl2 作氧化剂制得的
B、F2是最强的氧化剂
C、所有卤素都可以通过电解熔融卤化物得到
D、碘是最强的还原剂
27、加NH3·H2O于Hg2Cl2上,容易生成的是
A、 Hg (OH)2 B、 [Hg(NH3)4]2+
C、 [Hg(NH3)2]+ D、 HgNH2Cl + Hg
28、下列离子中,最易水解的离子是
A、 Na+ B、 Ca2+ C、 K+ D、 Al3+
29、下列物质中不是一元酸的是
A、CH3COOH B、 H3PO2 C、H3BO3 D、 H3PO4
30、下列含氧酸中属于三元酸的是
A、 H3BO3 B、 H3PO2 C、 H3PO4 D、CH3COOH
31、NH4NO2中N的氧化数是
A、+1,-1 B、+1,+5 C、 -3,+5 D、 -3,+3
32、下列氢氧化物中不溶于过量NaOH溶液的是
A、Cr(OH)3 B、 Zn(OH)2 C、Mg(OH)2 D、Pb(OH)2
参考答案:
1、C 2、D 3、B 4、D 5、D 6、C 7、C 8、A 9、C 10、B
11、B 12、C 13、A 14、B 15、C 16、B 17、D 18、C
19、B 20、B 21、D 22、C 23、C 24、C 25、C 26、C
27、D 28、D 29、D 30、C 31、D 32、C
判断题
1、M电子层原子轨道的主量子数都等于3。
2、BaSO4在纯水中的溶解度与在生理盐水中都一样。
3、根据缓冲溶液的pH=pKa+lg[CB/CHB],从数学式看,只要调整CB/CHB,任何一对缓冲对都可以配制任何pH值的缓冲溶液。
4、AgCl饱和溶液的导电能力很弱,所以AgCl为弱电解质。
5、在Mg(OH)2饱和溶液里,[OH-]等于其溶解度。
6、在多电子原子中,钻穿效应造成能级交错。
7、在配合物中,中心原子的配位数等于配体的个数乘以配合物的齿数。
8、主量子数为3时,有9个原子轨道。
9、将固体NaAc加到0.1mol/L HAc溶液中,将使HAc溶液的解离度增大。
10、氢键是没有方向性和饱和性的一类化学键。
11、σ键是以“头碰头”的方式成键的。
12、原子形成共价键的数目不能超过该基态原子的未成对电子数。
13、次磷酸(H3PO2)是一元弱酸,呈氧化性。
14、汞是熔点最低的金属。
15、在元素周期表中每一周期元素的个数正好等于相应的最外层电子轨道可以容纳的电子数目。
16、通常原子半径的数据并不是指单独存在自由原子本身的半径。
17、有极性键的分子—定是极性分子。
18、分子间的范德华力与分子大小很有关系,结构相似的情况下,分子越大范德华力也越大。
19、除氟外,各种卤素都可以生成几种含氧酸根.例如ClO4-,ClO3-,ClO2-,ClO-。在这些酸根中,卤素的氧化态越高,它的氧化能力就越强,即ClO4->ClO3->ClO2->ClO-。
20、杂化轨道成键能力大于未杂化前的轨道。
21、若键是极性的,则分子一定是极性分子。
22、主量子数为3时,有3s,3p和3d 三个原子轨道。
23、杂化轨道的数目等于未杂化前的轨道的数目。
24、若键是非极性的,则分子一定是非极性分子。
25、同类分子中,分子越大,范德华力越大。
26、O3为直线型分子。
27、CrO5中Cr的氧化数为 +10。
28、σ 键比π键牢固, π键只能与σ键共存。
29、色散力存在于所有分子之间。
30、色散力只存在于非极性分子之间。
31、分子间氢键是有方向性和饱和性的一类化学键。
32、原电池中正极发生氧化反应,负极发生还原反应。
33、最外层电子组态为np3或np4的元素,属于p区元素。
34、同类分子中,分子越大,色散力越大。
35、缓冲溶液稀释后,溶液的pH值基本不变,缓冲能力也不变。
36、原子形成共价键的数目可不等于该基态原子的未成对电子数
37、公式α=(K/C)1/2,表明弱酸的浓度越稀,解离度越大,酸性越强。
38、相同类型的难溶电解质可用溶度积来直接比较其溶解度的大小。
39、范德华力以色散力为主。
40、将反应Cr2O72-+14H++6Cl-=2Cr3++3Cl2+7H 2O组成原电池,可表示为(-)Pt(s)|Cr2O72-(c1), Cr3+(c2),14H+(c3)‖Cl-(c4)|Cl2(p) ,Pt(s)(+)
41、总浓度一定时,缓冲溶液的缓冲比越大,其缓冲容量就越大。
42、H2O分子的空间构型为V型。
43、σ键是以“肩并肩”的方式成键的,它可以单独存在。
44、相同类型的配合物,稳定常数越大,配合物的稳定性就越高。
45、因[Ag(CN)2]-的Ks=1.26×1021,[Ag(NH3)2] +的Ks=1.1×107,故在水溶液中[Ag(CN)2]-比[Ag(NH3)2]+稳定
。
46、氢键是有方向性和饱和性的一类分子间作用力。
47、同一种原子在不同的化合物中形成不同键时,可以是不同的杂化态。
48、若溶液的pH值越小,则溶液的酸度也越小。
49、范德华力是有方向性和饱和性的一类分子间作用力。
50、NH3分子的空间构型为V型。
51、π键能单独存在。
52、在配合物中,中心原子的配位数等于配体的个数。
53、H2O与NH3都是以不等性的sp3 杂化方式成键的。
54、缓冲溶液稀释后,溶液的pH值基本不变,缓冲能力减弱。
55、难溶电解质可用溶度积来直接比较其溶解度的大小。
56、主量子数为4时,有4s,4p和4d三个原子轨道。
57、将固体NaAc加到0.1mol/L HAc溶液中,将使HAc溶液的离解度增大。
58、π键是以“肩并肩”的方式成键的,它可以单独存在。
59、在O2中,O的氧化值和化合价均为2。
60、氢电极的电极电位是0.0000伏。
61、两电对组成原电池,标准电极电位大的电对中的氧化型物质在电池反应中一定是氧化剂。
62、s区元素原子的内电子层都是全充满的。
63、饱和甘汞电极中,增加Hg和糊状Hg2Cl2的量不会影响此电极的电极电势。
64、2px、2py、2pz 原子轨道的角度分布在形状和伸展方向上完全相同。
65、两种难溶电解质Ksp较大者, 其溶解度也较大。
66、不确定原理表明,同时准确测定电子的的位置和运动速率是不可能的。
67、硼酸是一种三元弱酸。
68、卤素单质的沸点随分子量的增大而升高。
69、汞是常温下为液态的金属。
70、标准氢电极电势为零是人为规定的。
71、电子出现概率的大小决定于概率密度和体积,因此概率密度大,概率不一定大。
72、电极电位只取决于电极本身的性质,而与其它因素无关。
73、在同一原子中,绝不可能有两个电子的运动状态完全相同。
问答题;
1、 临床上用来治疗碱中毒的针剂NH4Cl,其规格为20ml一支,每支含0.16gNH4Cl,计算该针剂的物质的量浓度及每支针剂中含的NH4Cl物质的量。(NH4Cl的摩尔质量为53.5)
2、 求0.1mol/L HAc溶液的pH值 (HAc的Ka=1.76×10-5)
3、(10分)已知Mn的元素电势图为:
![]()
(1)求φθ(MnO4-/Mn2+)。
(2)指出可能发生的歧化反应,并写出反应方程式。
4、(10分)某元素的原子序数为24,
(1)写出基态原子的电子组态,指出价电子;
(2)该原子有多少主层、多少亚层、多少单电子;
(3)该元素位于元素周期表的第几周期第几族;
5、填表
|
[CoCl(NH3)( H2O)4]SO4 |
命名: |
(2分) |
内界: |
(2分) |
外界: |
(2分) |
中心原子: |
(1分) |
配位体: |
(1分) |
配位原子: |
(1分) |
配位数: |
(1分) |
6、某元素的原子序数为29,
(1)写出基态原子的电子组态,指出价电子;
(2)该原子有多少主层、多少亚层、多少单电子;
(3)该元素位于元素周期表的第几周期第几族;
7、在0.20mol·L-1 K[Ag(CN)2]溶液中,加入KCN固体,使CN-离子的浓度为0.20mol·L-1,然后再加入KI固体,使I-离子的浓度为0.50mol·L-1能否产生沉淀?(已知KS =1.3×1021,Ksp(AgI)=8.5×10-17)
8、根据晶体场理论完成下表(Do为八面体场分裂能,P为电子成对能):
配离子 |
d电子的排布 |
CFSE的计算值 |
高自旋或低高自旋 |
稳定性好的 配离子是 |
[26FeF6]4- |
|
|
|
|
[26Fe(CN)6]4- |
|
|
|
9、298K时,测得电池
(-) Ag︱[Ag(CN)2]- (0.010 mol·L-1),CN- (0.010 mol·L-1)‖SCE (+)
的电池电动势为0.5723V,已知 ![]() SCE = 0.2412 V
SCE = 0.2412 V
(1) 计算负极电极电势;
(2) 计算[Ag(CN)2]- 配离子的稳定常数。
10、某元素的原子序数为24,
(1)写出基态原子的电子组态,指出价电子;
(2)该原子有多少主层、多少亚层、多少单电子;
(3)该元素位于元素周期表的第几周期第几族;
11、0.20mol·L-1NH3水与0.20mol·L-1HCl等体积混合后的溶液的pH值?
(NH3水的Kb=1.79×10-5)
12、在含有0.10mol.L-1Cl-和0.10mol.L-1CrO42-的混合溶液中逐滴加入AgNO3溶液,
则哪一离子先沉淀?在溶液中继续加入Ag+,当另一种离子开始沉淀时第一种
离子在溶液中剩余的浓度为多少mol.L-1?
Ksp(AgCl)=1.56×10-10, Ksp(Ag2 CrO4)=9×10-12
13、已知 jθ(Pb2+/Pb) =-0.126, jθ(Sn2+/Sn) =-0.136,当[Sn2+] = 0.5 mol·L-1,
[Pb 2+] =0.150 mol·L-1时,下列反应Sn + Pb 2+![]() Sn 2+ + Pb的平衡常数K为多少?
Sn 2+ + Pb的平衡常数K为多少?
14、海水中Mg2+离子浓度为5×10-2,欲除去99%的Mg2+,pH应控制在多少?(已知Ksp Mg(OH)2=1.8×10-11)
15、0.0500gAgCl刚好溶解在5.00ml氨水中(设溶液体积不变),此氨水的最初浓度最低是多少?(已知Ksp(AgCl)=1.77×10-10,[Ag(NH3)2]+的K稳=1.12×107,AgCl的摩尔质量为143.34g/mol)
16、已知φθ(Ag+/Ag)=+0.7996V,并测知在其标准电极溶液中加入等体积的8.00mol/L的氨水后,电极电势变为0.3086V,试计算:
(1) 加入氨水后,电极溶液中[Ag+]为多大?
(2)[Ag(NH3)2]+的K稳为多大?
(3)φθ[Ag(NH3)2]+/Ag为多大?
17、在0.25mol.L-1磷酸溶液400ml中加入0.50 mol.L-1NaOH溶液多少ml,才能配制pH=7.40 的缓冲溶液:已知:H3PO4 pKa1 =2.12 ,pKa2 =7.21 ,pKa3 =12.36
18、已知:FeS的Ksp=1.59´10-19,CdS的Ksp=1.40´10-29,H2S的Ka1=9.1´10-8,Ka2=1.1´10-12。若在c(Cd2+)=c(Fe2+)=0.10mol/L、c(H+)=0.30mol/L溶液中通H2S,试问:
①当c(H2S)达到多大时,CdS才能沉淀?
②当c(H2S)达到并维持饱和(0.10mol/L)时,溶液中c(H+)和c(S2-)各为多少?此时FeS沉淀是否出现?
③为使FeS沉淀完全[即c(Fe2+)≤10-5mol/L],应将溶液的pH调至若干?
19、通过计算说明,当溶液中[CN-]和[Ag(CN)2]- 均为0.100mol/L时,加入KI固体使[I-]为0.100mol/L,能否产生AgI沉淀?(已知[Ag(CN)2]-的K稳=1.29×1021, AgI 的Ksp=8.51×10-17)
20、已知25℃时AgCl的Ksp=1.77×10-10,φθ(Ag+/Ag)=+0.7996V,
φθ([Ag(NH3)2]+/Ag)=+0.3730V,试问:
(1)φθ(AgCl/Ag)是多少?
(2)[Ag(NH3)2]+的K稳为多少?
21、计算298K时,AgBr在1.0L 1.0mol·L-1的Na2S2O3溶液中的溶解度为多少?向上述溶液中加入KI固体,使[I-]= 0.010 mol·L-1(忽略体积变化),有无AgI沉淀生成?
(已知KS (〔Ag(S2O3)2〕3-)=2.9×1013,Ksp (AgBr)=5.38×10-13,Ksp(AgI)=8.5×10-17 )
22、实验测得[Mn(CN)6]4-配离子的磁矩为2.00μB。试推断它们的中心原子的杂化类型和配合物的空间构型,指出是内轨型还是外轨型。
23、在0.10mol·L-1 K[Ag(CN)2]溶液中,加入KCN固体,使CN-离子的浓度为0.10mol·L-1,然后再加入KI固体,使I-离子的浓度为0.50mol·L-1能否产生沉淀?
(已知KS =1.3×1021,Ksp(AgI)=8.5×10-17)
24、298K时,测得电池
(-)Ag︱[Ag(CN)2]-(0.050 mol·L-1),CN-(0.050 mol·L-1)‖SCE(+)
的电池电动势为0.5723V,计算[Ag(CN)2]-配离子的稳定常数。
已知 ![]() SCE = 0.2412 V
SCE = 0.2412 V

