温州医科大学成人高等教育
医学检验专升本
分析化学练习题
一、选择题:
1、某组分含量在0.01%-1%之间,则属于
A、常量组分分析 B、微量分析 C、微量组分分析 D、痕量分析
2、以下叙述错误的是
A、被测物百分含量高于1%为常量组分分析。 B、称取样品量高于0.1g为常量分析。
C、取试液体积在10ml以上常量分析。 D、取试液体积在1ml以上常量分析。
3、关于鉴定反应的灵敏度叙述错误的是
A、鉴定反应的灵敏度用检出限量m和最低浓度1:G同时表示。
B、检出限量m是绝对量,m越小,灵敏度越高。
C、最低浓度1:G,G越小,灵敏度越高。
D、在定性分析中,要求检出限量m小于50μg,G大于1000。
4、化合物CH3CSNH2在定性分析中用来代替下列哪种物质
A、(NH4)2CO3 B、H2S C、CO(NH2)2 D、(NH4)2C2O4
5、在阳离子H2S系统分析中,第Ⅱ组的组试剂为下列哪种物质
A、NH3-NH4Cl, (NH4)2CO3 B、0.3mol/L HCl ,H2S
C、CH3CSNH2 D、NH3-NH4Cl , (NH4)2S
6、定性分析中进行对照试验的目的是
A、检查鉴定反应的酸度是否合适 B、检查试剂是否失效
C、检查鉴定反应是否有干扰离子 D、检查试剂或蒸馏水是否含有被鉴定离子
7、定性分析中进行空白试验的目的是
A、检查仪器是否洗净 B、检查鉴定反应条件是否合适
C、检查试剂或蒸馏水是否含有被鉴定离子 D、检查试剂是否失效
8、定性分析中进行空白试验时取的试液是
A、用已知离子代替试液 B、用蒸馏水代替试液
C、用纯有机试剂代替试液 D、用待鉴定的试液
9、在鉴定某离子时,怀疑配制试剂所用的水中含有被鉴定离子,应采取的措施是
A、加入掩蔽剂 B、改变反应条件
C、进行对照试验 D、进行空白试验
10、在进行阳离子系统分析前,必须进行提前分别鉴定的离子是
A、Na+、K+、NH4+ B、K+、Fe2+、Fe3+
C、NH4+、Fe2+、Fe3+ D、Ca2+、Na+、Fe3+
11、采用H2S系统分析,分离第四组阳离子时pH 的适宜缓冲体系是
A、NH3-NH4Cl pH≈9 B、HAc-NaAc pH≈5
C、NaOH-H3BO3 pH≈9 D、NaOH-KH2PO4 pH≈7
12、H2S系统分析法将常见阳离子分成五个组。第Ⅰ组阳离子包括哪几种离子?
A、Ag+,Hg22+ B、Ag+,Hg2+ C、Hg22+,Hg2+ D、Cd2+、Hg2+
13、下列数据中,有四位有效数字的是
A、[H +]=0.0911 B、pH=10.24 C、Mg%=20.36% D、Ca%=0.030%
14、下列情况引起随机误差的是
A、试剂中含有少量被测离子 B、读取滴定管读数时,最后一位数字估计不准
C、砝码锈蚀 D、移液管、容量瓶相对体积没有进行校准
15、以下情况产生的误差属于系统误差的是
A、指示剂变色点与计量点不一致 B、滴定管读数最后一位估测不准
C、称样时砝码数值记错 D、称量过程中天平零点稍有变动
16、关于有效数字的说法正确的是
A、有效数字中每一数字都是准确的。
B、有效数字位数的多少反映了测量值相对误差的大小。
C、有效数字中的末位数字是估计值,不是测量结果。
D、有效数字的位数与所采用的单位有关。
17、减免随机误差所采取的措施为
A、空白试验 B、回收实验 C、增加实验次数 D、对照实验
18、用移液管移取溶液时,残留液稍有不同,属于哪种误差
A、仪器误差 B、随机误差 C、方法误差 D、系统误差
19、在定量分析中,精密度与准确度之间的关系是
A、精密度高,准确度必然高 B、 准确度高,精密度也就高
C、精密度是保证准确度的前提 D、 准确度是保证精密度的前提
20、分析天平的零点稍有变动,所引起的误差属于
A、仪器误差 B、随机误差 C、方法误差 D、系统误差
21、不符合无定形沉淀的沉淀条件是
A、沉淀作用应在热溶液中进行 B、沉淀作用应在较浓的溶液中进行
C、迅速加入沉淀剂并不断搅伴 D、沉淀放置过液,使沉淀陈化
22、为了获得纯净而易过滤洗涤的晶形沉淀,要求沉淀时
A、定向速度大于聚集速度 B、聚集速度大于定向速度
B、定向速度,聚集速度都大 D、定向速度,聚集速度都小
23、下列哪项不是重量分析法对沉淀形式的要求
A、组成固定 B、溶解度小 C、纯净 D、易于过滤与洗涤
24、在下列叙述中,正确的是
A、在重量分析中,需高温灼烧才能得到称量形式的沉淀,应选玻璃砂芯坩埚或玻璃砂芯漏斗作为滤器。
B、同一种沉淀,小颗粒溶解度大。
C、重量分析,要求在溶液中沉淀溶解损失的量小于0.5mg。
D、引起后沉淀的原因是表面吸附、吸留、形成混晶。
25、在重量分析中,待测物质中含的杂质与待测物的离子半径相近,在沉淀过程中往往形成
A、混晶 B、吸留 C、包藏 D、后沉淀
25、沉淀法测定As2O3含量时,经处理得到Ag3AsO4沉淀形式,再经处理得到AgCl称量形式,则换算因子为
A、As2O3/6AgCl B、3As2O3/AgCl C、6As2O3/AgCl D、As2O3/AgCl
27、综合影响沉淀溶解度大小的因素,在重量分析法中,沉淀剂的用量为
A、稍过量 B、大大过量 C、刚好足量 D、稍不足
28、下列哪项将影响沉淀的纯净
A、酸效应 B、盐效应 C、共沉淀 D、配位效应
29、下列标准溶液中,能直接配制的是
A、HCl B、KMnO4 C、AgNO3 D、Na2S2O3
30、用酸碱滴定法测定固体ZnO的含量,属于哪种滴定方式?
A、置换 B、剩余 C、直接 D、间接
31、下列哪项不是滴定分析对化学反应的要求
A、反应要迅速 B、化学计量点与终点要一致
C、定量完成 ,无副反应 D、有合适的确定终点的方法
32、滴定度T AgNO3/KCl=0.007455g/mL,其含义是
A、1mL AgNO3标准溶液相当于0.007455 g KCl
B、1mlLKCl标准溶液相当于0.007455 g AgNO3
C、1mLAgNO3标准溶液中含有0.007455 g AgNO3
D、1mL KCl标准溶液含有0.007455 gKCl
33、滴定度T(K2Cr2O7/FeO)=0.01256g/ml,其含义是
A、1ml K2Cr2O7标准溶液相当于0.01256g的FeO
B、1mlFeO标准溶液相当于0.01256g的K2Cr2O7
C、1mlFe2+标准溶液相当于0.01256g的K2Cr2O7
D、1ml Cr6+标准溶液相当于0.01256g的FeO
34、滴定分析要求测定结果的相对平均偏差小于
A、0.2% B、0.02% C、2% D、0.5%
35、滴定分析对化学反应的要求,下列哪项是正确的?
A、定量完成、无副反应、反应速度快、有合适指示剂
B、定量完成、反应速度快、有合适指示剂、1:1反应
C、定量完成、无副反应、反应速度快、有合适指示剂、1:1反应
D、定量完成、无副反应、反应速度快、1:1反应
36.终点误差是由于指示剂的变色点与化学计量点不一致引起的误差,是属于
A、操作误差 B、仪器误差 C、方法误差 D、试剂误差
37、下表中的各种试剂按其纯度从高到低的顺序是
代号 1 2 3
规格 分析纯 化学纯 优级纯
A、 1 , 2 , 3 B、 3 , 1 , 2
C、 3 , 2 , 1 D、 2 , 1 , 3
38、分析纯试剂瓶签颜色、代号分别为
A、绿色,AR B、红色,AR C、蓝色,AR D、红色,CP
39、下列叙述正确的是
A、滴定分析法准确度高,灵敏度也高,可用于常量组分分析。
B、滴定分析对化学反应的要求是定量完成、无副反应、快速、有合适的指示剂。
C、滴定度THCl/NaOH的含义是1ml NaOH 标准溶液相当于被测物HCl的克数。
D、用分析纯试剂精确称量,即可配制标准溶液。
40、用0.1000mol·L-1NaOH标准溶液分别滴定下列多元酸(C=0.1mol·L-1)能形成两个突跃的为
A、水杨酸 Ka1=1.0×10-3 Ka2=4.2×10-13
B、邻苯二甲酸 Ka1=1.1×10-3 Ka2=3.9×10-6
C、酒石酸 Ka1=6.0×10-4 Ka2=1.6×10-5
D、顺丁烯二酸 Ka1=1.0×10-2 Ka2=5.5×10-7
41、在下列酸碱滴定中,由于滴定突跃不明显而不能用直接滴定法进行滴定分析的是
A、用HCl溶液滴定NaAc溶液(KaHAC=1.8×10-5)
B、用NaOH溶液滴定H2C2O4溶液(KaH2C2O4=5.4×10-2)
C、用HCl溶液滴定NaCN溶液(KaHCN=4.9×10-9)
D、用NaOH溶液滴定H3PO4溶液(Ka1H3PO4=7.6×10-3)
42、用NaOH标准溶液测定苯甲酸含量时,NaOH标准溶液用HCl标准溶液进行标定,而HCl标准溶液用无水Na2CO3进行标定,但是在实验前Na2CO3未经270°-300°C干燥至恒重,请问,测定结果
A、偏高 B、偏低 C、无影响 D、测定结果混乱
43、标定NaOH溶液常用的工作基准试剂
A、无水Na2CO3 B、邻苯二甲酸氢钾 C、H2C2O4 D、硼砂
44、关于酸碱指示剂,下列说法不正确的是
A、指示剂的变色范围越窄越好 B、指示剂本身是有机弱酸或弱碱
C、指示剂的理论变色点pH=pka
D、指示剂的变色范围必须全部落在滴定突跃范围之内
45、标定HCl溶液常用的工作基准试剂
A、Na2CO3 B、邻苯二甲酸氢钾 C、H2C2O4 D、硼砂
46、酸碱指示剂的变色范围
A、pKIN±1 B、pKIN±0.05916/n C、Ф,IN±1 D、Ф,IN±0.05916/n
47、以下叙述错误的是
A、HPO42-是H2PO4-的共轭碱; B、H2O是OH-的共轭酸;
C、Na+是NaOH的共轭酸; D、H2Ac+是HAc的共轭酸。
48、称取某混合碱试样1.2000g,将此试样溶于水,用0.1000mo1·L-1HCl标准溶液滴至酚酞变为无色,用去HCl溶液30.00ml,然后加甲基橙指示剂继续滴至橙色,又用去HCl溶液45.00ml,试判断试样的组成
A、NaOH与 Na2CO3 B、NaHCO3 与Na2CO3 C、NaOH与NaHCO3 D、NaHCO3
49、甲基红在pH=5的溶液中,呈现的颜色为
A、红色 B、橙色 C、黄色 D、无色
50、用NaOH标准溶液滴定H3PO4第二计量点产物是
A、Na3PO4 B、Na2HPO4 C、NaH2PO4 D、H3PO4
51、用NaOH标准溶液测定苯甲酸含量时,,NaOH标准溶液用草酸进行标定,而在实验前草酸长时间保存在干燥器中,请问,测定结果
A、偏高 B、偏低 C、无影响 D、测定结果混乱
52、测定(NH4)2SO4中的氮时,不能用NaOH标准溶液直接滴定,这是因为
A、NH3 的Kb太小 B、(NH4)2SO4不是酸
C、NH4+的Ka太小 D、(NH4)2SO4中含游离H2SO4
53、在H2S溶液中,若pH>pKa2,则存在的主要形体是
A、H2S B、HS- C、S2- D、HS- + S2-
54、用0.1 mol/L HCl滴定0.1 mol/L NaOH的突跃范围为9.7~4.3, 则0.01 mol/L HCl滴定0.01 mol/L NaOH的突跃范围应为
A、9.7~4.3 B、8.7~4.3 C、8.7~5.3 D、 10.7~3.3
55、用NaOH标准溶液滴定HAc,关于突跃范围大小的叙述,下列正确的是
A、突跃范围大小取决于浓度和KHAc B、突跃范围大小取决于浓度和KAc-
C、突跃范围大小取决于浓度 D、突跃范围大小取决于KHAc
56、下列操作中正确的是
A、用HCl滴定NaOH,以酚酞为指示剂,溶液呈粉红色为终点
B、用NaOH滴定HCl,以酚酞为指示剂,溶液呈粉红色为终点
C、用HCl滴定NaOH,以甲基红为指示剂,溶液呈红色为终点
D、用NaOH滴定HCl,以甲基红为指示剂,溶液呈橙色为终点
57、在配位滴定中,若金属指示剂与金属离子形成的配合物为胶体或沉淀状态,则在用EDTA滴定时,就会在终点时使EDTA置换指示剂的作用缓慢,引起终点拖长,这种现象称为指示剂的
A、僵化现象 B、封闭现象 C、水解效应 D、配位效应
58、对EDTA滴定法中所用的金属指示剂,要求它与被测金属离子形成的配合物的稳定常数KMIN
A、>KMY B 、< KMY /100 C、³100 KMY D 、³108
59、在配位滴定中,由于金属离子与指示剂形成的配合物的稳定性太大,当滴定至计量点后,虽滴入过量EDTA,也不能从金属指示剂配合物中置换出相应指示剂而变色,这种现象称为指示剂的
A、封闭现象 B、僵化现象 C、配位现象 D、酸效应
60、在配位滴定中,[H+]越大,则
A、αY(H)越小,对主反应影响越大 B、αY(H)越大,对主反应影响越大
C、αY(H)越小,对主反应影响越小 D、αY(H)越大,对主反应影响越小
61、在配位滴定中,指示剂铬黑T使用的酸度范围
A、pH:8—11 B、pH<6 C、pH>11 D、pH:10—13
62、形成配位化合物时,金属离子和配位剂的配位比一般都是
A、1:1 B、1:2 C、1:3 D、 1:4
63、标定EDTA 标准溶液的工作基准试剂为
A、K2CrO4 B、K2Cr2O7 C、MgSO4·7H2O D、Na2C2O
64、用EDTA法测定水的总硬度时,通常用EBT指示剂,则终点颜色为
A、蓝色 B、酒红色 C、亮绿色 D、橙色
65、在配位滴定中EDTA通常有哪些副反应
A、酸效应 与配位效应 B、酸效应 与共存离子效应
C、水解效应与配位效应 D、配位效应与共存离子效应
66、配位滴定中,单一金属离子M能否进行准确滴定的判别式
A、△lgCK≥6 B、lgCMSPKMY'≥6 C、lgCMSPKMY'≥10-8 D、△lgCK≥8
67、在配位滴定中金属离子通常有哪些副反应
A、酸效应 与配位效应 B、酸效应 与共存离子效应
C、水解效应与配位效应 D、配位效应与共存离子效应
68、EDTA与金属离子的配位特性中,下列哪项是错误的
A、组成简单(1:1) B、配位的广泛性 C、MY都无色 D、MY稳定
69、铬黑T的缩写为
A、EBT B、BET C、EDT D、OX
70、在配位滴定中,混合金属离子选择性滴定可能性的判别式是
A、lgCMSP·KMY’≥6 B、ΔlgC·K≥6 C、Ka·C≥10-8 D、lgCMSP·KMY≥6
71、在配位滴定中,影响滴定突跃范围的因素是
A、 △ф,与介质 B、△ф,与氧化剂和还原剂的浓度
C、lgK,MY与浓度 D、Ksp与浓度
72、αY=αY(H),说明
A、无酸效应 B、无共存离子效应
C、共存离子效应严重 D、无配位效应
73、间接碘量法测定时,必须控制的酸度
A、中性或弱酸性 B、强酸性 C、强碱性 D、弱碱性
74、在氧化还原滴定中,通常不采用下列哪种方法来加快反应速度。
A、增加反应物浓度 B、升高温度 C、加催化剂 D、利用诱导反应
75、间接碘量法标定Na2S2O3时,滴定至终点后,若立即回蓝,则可能是由于
A、K2Cr2O7与KI反应未完全 B、空气中的O2氧化I-
C、试剂中杂质的干扰 D、淀粉指示剂变质
76、在氧化还原滴定中,要使反应符合滴定分析的要求lgK,必需满足下列哪项要求
A、≥3(n+m) B、≥8 C、≥0.4 D、≥mn(ф1,-ф2,)/0.05916
77、标定KMnO4的工作基准试剂是
A、Na2CO4 B、K2Cr2O7 C、Na2CO3 D、ZnO
78、间接碘量法标定Na2S2O3时,滴定至终点后,若放置一段时间回蓝,则可能是由于
A、K2Cr2O7与KI反应未完全 B、空气中的O2氧化I-
C、试剂中杂质的干扰 D、淀粉指示剂变质
79、下列有关碘量法淀粉指示剂加入时间正确的是
A、直接碘量法,淀粉指示剂必须临近终点加入
B、间接碘量法,淀粉指示剂必须临近终点加入
C、间接碘量法,淀粉指示剂必须滴定前加入
D、碘量法,淀粉指示剂必须滴定前加入
80、间接碘量法的主要误差来源
A、碘的挥发和碘离子的氧化 B、碘的挥发
C、碘离子的氧化 D、Na2S2O3不稳定
81、用K2Cr2O7为工作基准试剂标定Na2S2O3时,近终点的颜色是
A、无色 B、浅黄色 C、浅兰色 D、稻草黄色
82、关于KMnO4法,下列错误的是
A、KMnO4法是以KMnO4为标准溶液的氧化还原滴定法。
B、测定时,溶液的酸度以控制在1mol/L左右为宜。
C、用HNO3调酸度。 D、以KMnO4自身指示剂。
83、下列叙述中正确的是
A、Na2S2O3溶液不稳定容易分解,其分解的原因是O2,CO2,嗜硫细菌等的作用。
B、用K2Cr2O7作基准试剂标定Na2S2O3时,若滴定至终点后,立即会出现回蓝现象,是因为空气中氧气氧化I-的结果。
C、直接碘量法不仅可以测定还原性物质,还可以测定氧化性物质。
D、氧化还原滴定中滴定突跃范围的大小随着溶液浓度的增大而增大。
84、关于KMnO4 法,下列叙述错误的是
A、KMnO4法通常以自身指示剂指示终点。
B、用KMnO4法测定H2O2含量时,为了加快反应速度,通常将H2O2溶液加热至75℃—85℃。
C、KMnO4法通常用H2SO4来调节酸度。
D、KMnO4法滴定时速度不能过快,要控制在慢,快,慢,否则,将导致误差。
85、Mohr method 通常用于测定下列哪些离子
A、Cl-,Br-,I- B、Cl-,Br- ,CN- C、Cl-,Br-,I- ,CN- D、 Cl-,Br-,I- ,CN- SCN-
86、用Volhard method 测定Cl-时,若未将氯化银沉淀过滤或未加硝基苯,则导致测定结果
A、偏高 B、偏低 C、不影响 D、无法决定
87、一含有NaCl、Na3PO4的试样,采取下列哪种方法测定Cl-最合适
A、Mohr method B、Volhard method
C、Fajans method D、以上方法都不行
88、Volhard method必需在哪种溶液中进行?
A、酸性、中性或弱碱性 B、强酸性 C、强碱性 D、中性或弱碱性
89、用Volhard method 测定Br-时,若未将碘化银沉淀过滤或未加硝基苯,则导致测定结果
A、偏高 B、偏低 C、不影响 D、无法决定
90、用AgNO3标准溶液测定生理盐水中NaCl含量时,由于标定AgNO3的工作基准试剂NaCl吸潮,将产生
A、正误差 B、平行结果混乱 C、负误差 D、无影响
91、在沉淀滴定中,用AgNO3标准溶液分别滴定相同浓度的Cl-、Br-、I-、【KSP(AgI)<KSP(AgBr)<KSP(AgCl),滴定突跃范围最大的离子是
A、Cl- B、Br- C、I- D、无法确定
92、用Fajans method 测定NH4Cl时,应控制的酸度
A、pH:6.5—10.5 B、Pka〈PH〈7.2 C、pH:6.5—7.2 D、强酸(HNO3)
93、Mohr method测定氯离子时,所用介质
A、酸性溶液 B、碱性溶液 C、中性溶液 D、中性或弱碱性溶液
94、用Volhard法测定NaBr的含量时,若终点颜色偏深,则测定结果
A、偏高 B、偏低 C、无影响 D、测定结果混乱
95、在下列叙述中,正确的是
A、Mohr method 通常不适宜测定Br-,I-。
B、在沉淀滴定中,用AgNO3标准溶液分别滴定相同浓度的Cl-、Br-、I-,滴定突跃范围最大的离子是Cl-。
C、用Volhard method 测定I-时,若未将碘化银沉淀过滤或未加硝基苯,对测定结果无影响。
D、在吸附指示剂法中,胶体微粒对指示剂的吸附应略小于对被测离子的吸附,否则,导致终点拖后。
96、在下列叙述中,错误的是
A、Mohr method在测定中指示剂用量太多,会导致终点提前。
B、用Fajans method 测定NH4Cl含量时,酸度应控制在pH:6.5~7.2。
C、用Fajans method 进行测定时,被测离子的浓度应足够大。
D、Volhard method 测定Ag+是属于直接滴定方式。
97、在Fajans method 中,为了使沉淀保持胶状,通常要加入
A、淀粉 B、不需加任何试剂 C、荧光黄 D、AgNO3
98、用Volhard method 测定I-时,若未将氯化银沉淀过滤或未加硝基苯,则导致测定结果
A、偏高 B、偏低 C、不影响 D、无法决定
99、用Fajans method 测定NH4Cl时,应控制的酸度
A、pH:6.5—10.5 B、pka〈pH〈7.2 C、pH:6.5—7.2 D、强酸(HNO3)
100、当测定生物试样的某些组分时,蛋白质常有干扰,须于测定前除去,下列哪种是最佳的去蛋白剂
A、10%三氯醋酸 B、6%高氯酸 C、丙酮 D、乙醇
101、溶解BaSO4试样,应采取
A、水溶法 B、酸溶法 C、碱溶法 D、熔融法
102、分析工作中,要使分析的结果反映整体物料的情况,采集到的试样必须满足下列哪种要求 ,否则,无实际意义。
A、针对性 B、代表性 C、时间性 D、真实性
参考答案:
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
C |
D |
C |
B |
B |
B |
C |
B |
D |
C |
A |
A |
C |
B |
A |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
B |
C |
B |
C |
B |
D |
A |
A |
B |
A |
A |
A |
C |
C |
B |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
B |
A |
A |
A |
A |
C |
B |
B |
B |
D |
A |
A |
B |
D |
D |
46 |
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
58 |
59 |
60 |
A |
C |
B |
B |
B |
B |
C |
C |
C |
A |
B |
A |
B |
A |
B |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
72 |
73 |
74 |
75 |
A |
A |
C |
A |
B |
B |
C |
C |
B |
B |
C |
B |
A |
D |
A |
76 |
77 |
78 |
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
87 |
88 |
89 |
90 |
A |
A |
B |
B |
A |
D |
C |
A |
B |
B |
B |
B |
B |
C |
A |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
|
|
|
C |
C |
D |
B |
C |
B |
A |
C |
B |
B |
A |
B |
|
|
|
二、是非题:
1、用K4[Fe(CN)6]鉴定Fe3+时,怀疑配制试液的蒸馏水中含有Fe3+,这时应作空白试验。
2、在H2S系统分析法中:NH4+、 Fe2+、Fe3+要在原试液中检出。
3、鉴定反应的灵敏度可用检出限量m和最低浓度1:G表示,则G值越大,灵敏度越高。
4、空白试验是检查试剂是否失效、反应条件是否控制得当。
5、在H2S系统分析法中,通常用硫代乙酰胺代替H2S。
6、称取样品量高于0.1g为常量分析。
7、H2S系统分析法中第三组阳离子是:Cu2+、Zn2+ 、 Pb2+、Hg2+、As3+。
8、H2S系统分析法中第四组阳离子是:Ba2+、Ca2+。
9、在H2S系统分析法中第二组阳离子是:Cu2+、Zn2+ 、 Pb2+、Hg2+、As3+
10、在定性分析中,最低浓度1:G应小于1:1000。
11、鉴定反应的灵敏度用检出限量m和最低浓度1:G同时表示。
12、化学分析方法与仪器分析方法比较,化学分析方法准确度高,而仪器分析方法灵敏度高。
13、系统误差可用增加平行测定次数的方法减免。
14、相对平均偏差越小,分析结果的精密度越高,但准确度不一定高。
15、两组数据的精密度之间是否存在显著性差异,用t检验法检验。
16、Pka=10.75的有效数字是2位。
17、凡测定结果的精密度越高,其准确度也一定高。
18、有效数字的修约规则是四舍六入五留双。
19、系统误差可用校正的方法来减免。
20、终点误差是滴定终点与化学计量点不相符合引起的,是属于试剂误差。
21、随机误差可用校正的方法来减免。
22、t检验法用于检查是否存在系统误差。
23、将22.505修约成两位有效数字为22。
24、读取滴定管读数时,最后一位数字估计不准将引起仪器误差。
25、滴定管读数的最后一位估计不准确,属于随机误差。
26、精密度高是准确度高的前提条件,所以,测定结果的精密度高,其准确度也高。
27、由于盐效应的影响,使重量分析的结果偏高。
28、在重量分析中,影响沉淀纯净的因素是共沉淀和后沉淀。
29、由于同离子效应的影响,使重量分析的结果偏高。
30、重量分析法的准确度高,通常用于常量组分分析。
31、在重量分析中,对称量形式的要求是溶解度小、纯净、摩尔质量大。
32、为了获得纯净而易于过滤、洗涤的晶形沉淀,要求沉淀时的定向速度大而聚集速度小。
33、在重量分析中,沉淀洗涤的原则是少量多次。
34、在重量分析中,对沉淀形式的要求是溶解度小、纯净、易于过滤与洗涤。
35、在沉淀的形成过程中,若定向速度大而聚集速度小,则易形成晶形沉淀。
36、在重量分析中,为了减少误差,应利用盐效应,减少同离子效应、配位效应和酸效应。
37、在重量分析中,对于溶解度较小的无定形沉淀,通常用沉淀剂的稀溶液作为洗涤液。
38、BaSO4在稀硫酸中的溶解度比纯水中小。
39、按重量分析误差的要求,沉淀在溶液中溶解损失量应≤0.2mg。
40、在重量分析中,为了使沉淀完全,沉淀剂加得越多越好。
41、无定型沉淀的沉淀条件是浓,热,快搅,,加入适量电解质,不必陈化。
42、在重量分析法中,对于需高温灼烧才能得到称量形式的沉淀,应选择玻璃砂心坩埚作为滤器。
43、重量分析法中,同一种沉淀,其颗粒越大,沉淀溶解度也越大。
44、重量法将得到的沉淀进行烘干或灼烧,其目的就是为了除去水分。
45、用酸碱滴定法测定CaCO3的含量时,由于CaCO3为固体,故可采用置换滴定方式。
46、终点误差是滴定终点与化学计量点不相符合引起的,是属于操作误差。
47、滴定分析法的准确度高,灵敏度也高,可用于常量、微量组分分析。
48、分析纯试剂瓶签颜色为红色,代号AR。
49、在滴定分析中,基准物质是可用来直接配制或标定标准溶液的物质。
50、在滴定分析中,基准物质是指高纯度(含量大于99.9%)的物质。
51、化学计量点不一定在滴定突跃的中点。
52、在滴定分析中,要求相对平均偏差小于0.5%。
53、滴定度T(K2Cr2O7/FeO)的含义是1ml K2Cr2O7相当于被测物FeO 的克数。
54、滴定终点指的是加入的标准溶液与被测物完全反应的点。
55、滴定分析对化学反应的要求是定量完成,并化学计量点与滴定终点尽可能一致。
56、分析纯试剂可用来直接配制标准溶液。
57、滴定分析对化学反应的要求是定量完成、快速、无副反应、有合适指示剂指示终点。
58、已知某指示剂的pKHIn=5.30,HIn显黄色,In-显蓝色,过渡色为绿色,则指示剂
在pH=4.00的溶液中显蓝色。
59、当用HCl溶液滴定NaOH时,甲基橙指示剂用量越多,变色越灵敏,滴定误差越小。
60、HCO3-的共轭碱是CO32-。
61、用0.1000mol·L-1NaOH标准溶液滴定磷酸H3PO4(C=0.1mol·L-1)能形成两个突跃。(H3PO4的Ka1=7.6×10-3 Ka2=6.3×10-8 Ka3=4.4×10-13)
62、用NaOH溶液滴定HCl时,酚酞指示剂用量越多,变色越灵敏,滴定误差越小。
63、在HAc溶液中,当pH<pka时,溶液中主要存在型体为Ac-。
64、某酸碱指示剂的K(HIn)为1.0×10-5,其变色点pH为4~6。
65、在强酸滴定强碱中,滴定突跃范围的大小与酸碱浓度有关,浓度越小,滴定突跃范围也越小。
66、用0.1 mol/L NaOH 溶液滴定0.1 mol/L HAc ,应选酚酞作指示剂。
67、用0.1 mol/L NaOH滴定HAc的突跃范围为7.7~9.7,则用0.01 mol/L NaOH滴定HAc的突跃范围6.7~8.7。
68、在草酸溶液中,当pH<pKa1时,存在的主要形体是H2C2O4。
69、硼砂是标定NaOH溶液常用的工作基准试剂。
70、酸碱指示剂选择的依据是化学计量点。
71、当用NaOH溶液滴定HCl时,酚酞指示剂用量在不影响灵敏度的情况下,,尽可能少加。
72、邻苯二甲酸氢钾是标定NaOH溶液常用的工作基准试剂。
73、用0.05000 mol/L NaOH滴定0.05000 mol/L H3PO4(已知H3PO4的Ka1 = 7.6×10-3, Ka2 = 6.3×10-8, Ka3 = 4.4×10-13)至第一化学计量点产物是Na2HPO4。
74、指示剂选择的依据滴定突跃范围。
75、NH4+的酸性太弱,用NaOH直接滴定时突跃太小而不能准确滴定。采用返滴定法能准确测定。
76、MgSO4·7H2O为标定EDTA的基准试剂。
77、EDTA与M形成的配合物都无色。
78、EBT在pH=10.00的溶液中显酒红色。
79、在配位滴定中,当达到计量点后,再加入过量的标准溶液,则终点颜色不会加深。
80、水的总硬度有三种表示方法,若以度表示,则1度表示1升水中含1mgCaCO3。。
81、EBT使用的酸度范围是pH :5~6。
82、aM(L)=1表示 M与L的副反应相当严重。
83、铬黑T的缩写为EBT。
84、EDTA标准溶液必须采用间接法配制。
85、在配位滴定中,滴定曲线突跃区间的大小只决定于条件稳定常数。
86、在碘量法中,指示剂淀粉应在近终点时加入。
87、在KMnO4法中,通常用H2SO4 或HCl或HNO3来调节酸度。
88、KMnO4法通常用自身指示剂。
89、条件电位Φ′与介质的种类有关,而与介质的浓度无关。
90、用K2Cr2O7标定Na2S2O3时,如果K2Cr2O7与KI反应未完全就开始滴定,则滴定至终点后,立即会出回蓝现现象。
91、氧化还原滴定中滴定突跃范围的大小随着溶液浓度的增大而增大
92、直接碘量法通常可用于测定氧化性物质与还原性物质。
93、Na2S2O3标准溶液, 必须用间接法配制。
94、 用KMnO4法测定H2O2含量时,为了加快反应速度,通常将H2O2溶液加热至75℃—85℃。
95、间接碘量法的主要误差来源是Na2S2O3不稳定。
96、氧化还原滴定中,条件电位差值越大,其滴定突跃范围越大。
97、Mohr Method所用的指示剂是K2CrO4。
98、Volhard Method必须在中性或弱碱性溶液中进行测定。
99、扬斯法中,为了防止沉淀凝聚,使之保持胶体状态,通常加入淀粉或糊精等胶体保护剂。
100、用Mohr Method测定NH4Cl含量时,pH控制在6.5-10.5。
101、Volhard Method必须在强酸性(HNO3)溶液中进行测定。
102、Mohr Method所用的指示剂是铁铵矾。
103、Mohr method在测定中指示剂用量太多,会导致终点提前。
104、Fajans法是以吸附指示剂指示终点的银量法。
105、Mohr法可用于测定Cl-、Br-、I-、SCN-。
106、用Volhard法测定Br-时,为了防止沉淀转换,通常将AgBr滤去,或加硝基苯。
107、Fajans法是以K2CrO4为指示剂的银量法。
108、用Volhard method 测定Cl-时,未加硝基苯,则分析结果偏低。
109、分析工作中,采集到的试样必须具有代表性,否则,无实际意义。
110、生物试样的消化,通常有干式消化、湿式消化、密封消化、酶消化。
111、当测定生物试样的某些组分时,蛋白质常有干扰,须于测定前除去,高氯酸是最佳的去蛋白剂。
参考答案:
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
√ |
√ |
√ |
× |
√ |
√ |
× |
√ |
× |
√ |
√ |
√ |
× |
√ |
× |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
√ |
× |
√ |
√ |
× |
× |
√ |
× |
× |
√ |
× |
× |
√ |
× |
√ |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
× |
√ |
√ |
√ |
√ |
× |
× |
√ |
√ |
× |
√ |
× |
× |
× |
× |
46 |
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
58 |
59 |
60 |
× |
× |
√ |
√ |
× |
√ |
× |
√ |
× |
× |
× |
√ |
× |
× |
√ |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
72 |
73 |
74 |
75 |
√ |
× |
× |
× |
√ |
√ |
× |
√ |
× |
× |
√ |
√ |
× |
√ |
× |
76 |
77 |
78 |
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
87 |
88 |
89 |
90 |
√ |
√ |
× |
√ |
× |
× |
× |
√ |
× |
× |
× |
× |
√ |
× |
√ |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
104 |
105 |
× |
× |
√ |
× |
× |
√ |
√ |
× |
√ |
× |
√ |
× |
√ |
√ |
× |
106 |
107 |
108 |
109 |
110 |
111 |
|
|
|
|
|
|
|
|
|
× |
× |
√ |
√ |
√ |
√ |
|
|
|
|
|
|
|
|
|
三、填空题:
1、在H2S系统分析法中,通常 离子要在原试液中鉴出。
2、鉴定反应的灵敏度一般用 与 同时表示。
3、空白试验是以 代替试液,在相同的条件下,以相同的方法对同一种离子进行鉴定,其目的是 。
4、对照试验是以 代替试液,在相同条件下进行鉴定反应,其目的是 。
5、在定性分析中,用 来代替硫化氢。
6、H2S系统分析法将常见阳离子分成五个组。第Ⅰ组阳离子包括 离子,组试剂 。
7、H2S系统分析法将常见阳离子分成五个组。第Ⅱ组阳离子包括离子,组试剂为 。
8、H2S系统分析法将常见阳离子分成五个组。第Ⅲ组阳离子包括 离子,组试剂为 。
9、H2S系统分析法将常见阳离子分成五个组。第Ⅳ组阳离子包括 离子,组试剂为 。
10、H2S系统分析法将常见阳离子分成五个组。第V组阳离子包括 离子。
11、有效数字的修约规则 ,
若将4.5245修约成四位有效数字为 ,
0.3120×48.12+(21.15-16.1)÷(0.2845×12.34)
的计算结果应取 位有效数字。
12、检查和校正系统误差的试验方法 。
13、在重量分析中,对称量形式的要求是 , , 。
14、在重量分析中,对沉淀形式的要求是 , , 。
15、重量分析中,换算因子F的含义 。
16、为了获得纯净而易于过滤、洗涤的晶形沉淀,要求沉淀时的
速度大而 速度小。
17、在重量分析中,影响沉淀纯净的因素是
18、滴定分析对化学反应的要求是定量完成 ,
, 。
19、滴定度Tk2cr2o7/FeO=0.005700g/ml,其含义为 。
20、分析纯试剂瓶签颜色为 ,代号 。
21、酸碱指示剂选择的依据是 ,原则是 。
22、在HAc溶液中,当pH<pka时,溶液中主要存在型体为 。
23、酸碱指示剂的变色范围 。
24、EDTA的学名是 。
25、在配位滴定中,当达到计量点后,再加入过量的标准溶液,则终点颜色
(加深或变浅或不改变)。
26、EDTA与金属离子的配位特性 , ,
, 。
27、配位滴定中,影响滴定突跃的主要因素有 、 。
28、络合滴定中,通常将lgCspK’MY≥ 作为能准确滴定的条件,络合滴定中条件稳定常数越大,其滴定突跃范围越 。
29、在配位滴定中EDTA通常有 和 两种副反应。
30、用K2Cr2O7标定Na2S2O3时,如果K2Cr2O7与KI反应未完全就开始滴定,则滴定至终点后,立即会出现 现象。
31、KMnO4法是以KMnO4为标准溶液的氧化还原滴定法,测定时,溶液的酸度以控制在1mol/L左右为宜,若酸度过高,会导致 ,酸度过低,会产生 。须用 调节酸度。
32、KMnO4法通常用 作指示剂。
33、碘量法的误差来源时 和 。
34、在间接碘量法中,指示剂淀粉应在 时加入。
35、氧化还原滴定中,条件电位差值越大,其滴定突跃范围越 。
36、Na2S2O3溶液不稳定容易分解,其分解的原因是 的作用,
的作用, 的作用。
37、用K2Cr2O7标定Na2S2O3时,若滴定至终点后,立即会出现回蓝现象,这是由于 。
38、在Fajans method 中,为了使沉淀保持胶状,通常要加入 和
等胶体保护剂。
39、用银量法进行沉淀滴定,根据确定终点所用指示剂可分为三种方法,它们分别是 、 、 。
40、用Fajans method 测定NH4Cl时,应控制的酸度 。
41、用Volhard法测定KI的含量时,若终点颜色偏深,则测定结果 (偏高或偏低)。
42、在Fajans法中,若胶状沉淀对指示剂阴离子的吸附能力太强,则导致终点
(提前或拖后)
43、在沉淀滴定中,用AgNO3分别滴定相同浓度的Cl-、Br-、I-、【KSP(AgI)<KSP(AgBr)<KSP(AgCl)=滴定突跃范围 离子最大。
44、Volhard method是以 为指示剂的银量法,用Volhard method法测定Cl-时,若指示剂用量过多,则导致结果 (偏高或偏低),用Volhard method法测定Cl-时,为了防止沉淀转换,通常采取 或 措施。
45、生物试样的消化,通常有 , , , 。
46、分析工作中,采集到的试样必须具有 。否则分析工作无论如何认真,测定结果如何准确,也无实际意义。
47、当测定生物试样的某些组分时,蛋白质常有干扰,须于测定前除去,最佳的去蛋白剂是 。
48、溶解BaSO4试样,可采取 方法。
49、采集生物试样的一般原则是: , , 。
50、当测定生物试样的某些组分时,蛋白质常有干扰,须于测定前除去,下列哪种是最佳的去蛋白剂是 。
答案:
1、Fe2+ 、Fe3+、NH4+
2、检出限量,最低浓度
3、蒸馏水,检查所用的试剂、蒸馏水及器皿中是否含有被检离子。
4、已知离子溶液,检查所用试剂是否失效、反应条件的控制是否得当。
5、硫代乙酰胺
6、Ag+,Hg22+两种,稀HCl
7、Cu2+、Pb2+、Cd2+、Hg2+、As3+等五种,0.3mol·L-1 HCl溶液中通H2S
8、Cr3+,Fe2+,Fe3+,Mn2+,Zn2+等五种,在NH3-NH4Cl存在下加(NH4)2S
9、Ba2+,Ca2+两种,在NH3-NH4Cl条件下,加(NH4)2CO3
10、Mg2+,K+,Na+,NH4+四种。
11、四舍六入五单进(留双),4.524,3
12、对照试验、回收试验、空白试验
13、组成固定,性质稳定,摩尔质量大
14、溶解度小,纯净,易于过滤和洗涤
15、1克称量形式相当于被测物的克数。
16、定向,聚集
17、共沉淀和后沉淀
18、反应迅速,有合适的指示剂,无副反应
19、1ml K2Cr2O7标准溶液相当于0.005700g被测物FeO。
20、红色,AR
21、滴定突跃范围,指示剂的变色范围必须全部或一部分落在滴定突跃范围之内。
22、HAc
23、pH=pKHin + 1
24、乙二胺四乙酸
25、不改变
26、配位的广泛性,组成简单,配合物稳定,大多配合物无色
27、浓度,条件稳定常数
28、6,越大
29、酸效应和共存离子效应
30、回蓝现象
31、KMnO4分解,MnO2沉淀,H2SO4
32、自身指示剂
33、I-的氧化和I2的挥发
34、近终点
35、大
36、CO2 ,空气中O2 ,嗜硫细菌。
37、K2Cr2O7与KI反应未完全所致.
38、淀粉或糊精
39、Mohr method、Volhard method、Fajans method
40、pKa<PH<7.2
41、偏低
42、提前
43、I-
44、铁铵矾,偏高,过滤氯化银沉淀或未加硝基苯
45、干式消化、湿式消化、密封消化、酶消化。
46、代表性
47、高氯酸
48、熔融法
49、有代表性,有针对性,有时间性
50、高氯酸
四、计算题:
1、测定某患者血清铁时,某工作者测了五次,其含量分别为17.26、17.18、17.25、17.20、17.23umo1·L-1。试计算相对平均偏差为多少?应以多少浓度报出结果。
2、测定某患者血清铁时,某工作者测了五次,其含量分别为17.26、17.18、17.25、17.20、17.23umo1·L-1。用G检验法判断置信度为95%时,有无可疑值舍弃?
置信度为95%时的G如下:
N |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
G |
1.15 |
1.46 |
1.67 |
1.82 |
1.94 |
2.03 |
2.11 |
3、测定某患者血清锌时,某工作者测了五次,其含量分别为12.26、12.18、12.25、12.20、12.23umo1·L-1。计算平均值在95%置信度时的置信区间。
置信度为95%时的Q,ta,f值分别如下:
f |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
ta,f |
4.30 |
3.18 |
2.78 |
2.57 |
2.45 |
2.36 |
2.31 |
4、测定某患者血清锌时,某工作者测了五次,其含量分别为12.26、12.18、12.25、12.20、12.23µmol/L,用Q检验法判断置信度为95%时,有无可疑值舍弃?
置信度为95%时的Q值分别如下:
n |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
Q |
0.94 |
0.76 |
0.64 |
0.56 |
0.51 |
0.47 |
0.44 |
5、测定体液中Cl-的含量 ,结果为:0.097,0.098,0.100,0.102,0.098 mol/L。求测定标准偏差、相对标准偏差。
6、测定某患者血清锌时,某工作者用光度法和原子吸收法分别进行测定,用光度法测了六次,其结果为9.56、9.49、9.62、9.51、9.58、9.63、μmol/L;用原子吸收法也测了六次,其结果为9.33、9.51、9.49、9.56、9.40、9.35、μmol/L。请问这两种方法的精密度之间有无显著性差异?
置值度为95%时的ta,f值如下表。
f |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
ta,f |
4.30 |
3.18 |
2.78 |
2.57 |
2.45 |
2.36 |
2.31 |
置值度为95%时的F值如下表
f大 f小 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
2 |
19.00 |
19.16 |
19.25 |
19.30 |
19.33 |
19.36 |
19.37 |
3 |
9.55 |
9.28 |
9.12 |
9.01 |
8.94 |
8.88 |
8.84 |
4 |
6.94 |
6.59 |
6.39 |
6.26 |
6.16 |
6.09 |
6.04 |
5 |
5.79 |
5.41 |
5.19 |
5.05 |
4.95 |
4.88 |
4.82 |
6 |
5.14 |
4.76 |
4.53 |
4.39 |
4.28 |
4.21 |
4.15 |
7 |
4.74 |
4.35 |
4.12 |
3.97 |
3.87 |
3.97 |
3.73 |
8 |
4.46 |
4.07 |
3.84 |
3.69 |
3.58 |
3.50 |
3.44 |
7、有一混合碱试样0.3020克,用0.1060mol/L HCl标准溶液滴定,以酚酞为指示剂滴定到终点时消耗HCl 为20.10 mL;继续以甲基橙为指示剂滴定到终点时共消耗HCl 27.60 mL,试判断混合碱试样的组成及含量各为多少?
(MNa2CO3=105.99,MNaOH=40.10,MNaHCO3=84.01)
8、通过计算说明用0.1000mol/l的NaOH标准溶液能否直接准确滴定柠檬酸H3C6H5O7?若能,请问有几个滴定突跃?计量点产物是什么?应选择什么作指示剂?(已知:柠檬酸的Ka1=7.4×10-4, Ka2=1.7×10-5 , Ka3=4.0×10-7)
9、通过计算说明用硼砂标定0.1mol/l的HCl标准溶液时,有几个滴定突跃?计量点产物是什么?应选择什么作指示剂?(已知:硼酸的Ka1=5.8×10-10, Ka2=1.8×10-13 , Ka3=1.6×10-14)
10、有一混合碱试样1.200克,用0.1000mol/L HCl标准溶液滴定,以酚酞为指示剂滴定到终点时消耗HCl 为30.00 mL;继续以甲基橙为指示剂滴定到终点时又消耗HCl标准溶液 45.00 mL,试判断混合碱试样的组成及含量各为多少?
(MNa2CO3=105.99,MNaOH=40.10,MNaHCO3=84.01)
11、称取干燥AI(OH)3凝胶0.3896g于250ml容量瓶中,溶解后吸取25.00ml,精密加入0.05000mol/L的EDTA液25.00ml,过量的EDTA液用0.05000mol/L标准锌溶液返滴,用去15.02ml,求样品中AI2O3含量(MAI2O3=101.94)
12、在0.010mol/L HNO3溶液中,能否用2.0×10-2 mol/L EDTA溶液准确地选择性滴定相同浓度Fe3+和Cd2+混合溶液中的Fe3+?
(已知:lgKFe(Ⅲ)Y=25.1 lgKCdY=16.46 pH=2.0 时, lgαY(H)=13.51 )
13、收集24 h尿样共2.00 L,用EDTA滴定。( 1 )取10.0 mL上述尿样,加入pH = 10的缓冲溶液,用0.00500 mol /L的EDTA滴定,消耗23.5 mL; (2 )另取10.0 mL该尿样,使Ca2+形成CaC2O4沉淀除去,仍用同浓度的EDTA滴定其中的Mg2+,需EDTA 12.0 mL,求尿样中Ca2+和Mg2+的质量浓度。 [ Mr(Ca) = 40.08 , Mr (Mg ) = 24.31 ]
14、测定水的总硬度时吸取水样100.00mL,在pH=10的氨性缓冲溶液中以铬黑T为指示剂,用0.00500 mol/L的EDTA标准溶液滴定,当达到终点时用去EDTA溶液10.25ml,分别求出以CaCO3mg/L和度表示的水的总硬度。
(MCaCO3=100.1 MCaO=56.08)
15、准确量取消毒液H2O25.00ml置于100ml容量瓶中,并稀释至刻度线,混匀,再准确量取25.00ml,酸化后,用0.02000mol/L KMnO4标准溶液滴定,用去 23.25ml,计算消毒液中H2O2的质量浓度(g/dl)MH2O2=34.01。
16、称取0.4207克石灰石样品,沉淀为CaC2O4,并溶解于H2SO4,需要浓度为0.03832mol/l的KMnO4溶液21.54ml滴定至终点,求石灰石中以CaCO3表示的百分率。(M CaCO3=100.08)
17、称取0.2010g草酸钠工作基准试剂,加入2mol/LH2SO4 25ml,用KMnO4标准溶液滴定至终点,用去KMnO4标准溶液24.25 ml,计算KMnO4标准溶液的浓度mol/L。
MNa2C2O4=134.00
18、血清Ca测定时,准确量取血清试样2.00mL,加入蒸馏水3mL,4%(NH4)2C2O4溶液1mL,离心,弃去上清液,沉淀用8%NH3·H2O分两次洗涤后,用0.5mol/LH2SO4溶液使CaC2O4溶解,在水浴上用0.00220mol/LKMnO4标准溶液滴定,用去1.56mL。求血清钙含量(mg/L)。MCa2+=40.08
19、临床上测定脑脊液中Cl- 含量时,准确量取0.50ml患者脑脊液,制得无蛋白滤液10.00ml,取出此无蛋白滤液5.00ml,用AgNO3标液进行滴定(TAgNO3/NaCl=0.00100g/ml),终点时用去AgNO3 1.38ml,计算脑脊液中Cl-的含量(g/dl).MCl-=35.45. MNaCl=58.44
20、有机物氯乙醇,比重为1.189g/ml,取此氯乙醇试样2.00ml,水解后稀释至20.00ml,再取稀释液2.00ml,加入0.09730mol/L AgNO3标准溶液50.00ml,滴定剩余的Ag+用去0.09255mol/L NH4SCN标准溶液21.20ml,求该氯乙醇试样中氯的质量分数。
MCl-=35.45
21、称取KCl样品0.5947g, 溶解,移入50ml容量瓶中,加水稀释至刻度,用移液管吸取25.00ml试液,用AgNO3(T AgNO3/KCl=0.007455g/ml)标准溶液滴定,用去标准溶液29.25ml,试计算KCl的百分含量(MKCl=74.55)
参考答案:
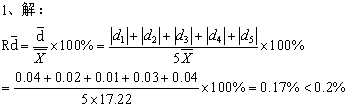
以平均值17.22报出结果。

3、
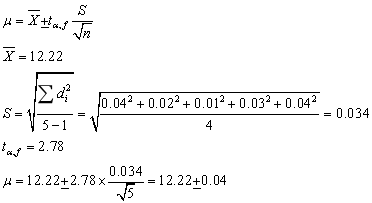
4、

5、

6、

7、 解: V1=20.10ml, V2=27.60-20.10=7.50ml
V1>V2 为 NaOH 与 Na2CO3

8、解:Cka1>10-8 , Cka2>10-8 , Cka3>10-8 , 所以能直接准确滴定。
因为ka1/ ka2<104 , ka2/ ka3<104 所以只有一个突越,
计量点产物为Na3C6H5O7
Kb1=Kw/Ka3=10-14/(4.0×10-7)=2.5×10-8
C Kb1>20 Kw C/ Kb1>500,
∴[OH-]===2.04×10-3
pH=9.31 选酚酞为指示剂。
9、解:由于硼砂的解聚作用 B4O72- +5H2O = 2H3BO3 + 2H2BO3-
∴ 用硼砂标定HCl,实际上是用HCl滴定H2BO3-
Kb(H2BO3-)=Kw/Ka1=10-14/(5.8×10-10)=1.72×10-5
所以用HCl能直接准确滴定H2BO3-,并只有一个突跃。
计量点产物为H3BO3
C Ka1>20 Kw C/ Ka1>500,
∴[H+]===7.6×10-6
pH=5.1 选甲基红为指示剂。
10、解:V1=30.00ml,V2=45.00ml V2>V1 为 NaHCO3 与 Na2CO3
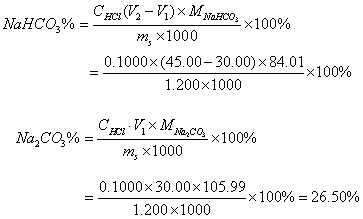
11、解:
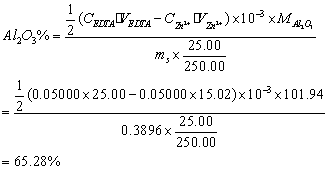
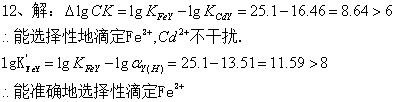
13、解: r (Mg) =CEDTA ´ V2 ´ M Mg2+ ´10-3/Vs
=0.00500 ´ 12.0 ´ 24.31´10-3/10.0
= 1.46 ´ 10-4 (g / mL)
r (Ca) =CEDTA ´ (V2 - V1)´ M Ca2+ ´10-3/Vs
= 0.00500 ´ ( 23.5 - 12.0 ) ´ 40.08´10-3/10.0
= 2.30 ´ 10-4 (g / mL)
14、解:
CaCO3mg/L=0.00500×10.25×MCaCO3/0.1
=0.00500×10.25×100.1/0.1
=51.3
度=0.00500×10.25×MCaO/(10×0.1)
=0.00500×10.25×56.08
=2.87
15、解:ρH2O2(g/dL)=Vs×25.00/100.00×10-2
=5.00×25.00/100.00×10-2
=3.16g/dL
16、解:CaCO3%=2ms×100%
=2×0.4207×100%==49.09%
17、解:2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑ +8H2O
∴ nKMnO4=2/5nNa2C2O4
C KMnO4=V=5V
=5×24.25×10-3
=0.02474 (mol/L)
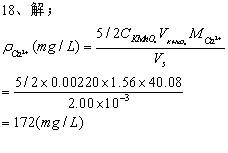
19、解:Cl(g/dL)=Vs×5.00/10.00×10-2
=0.50×5.00/10.00×10-2
=0.91g/dL
20、ωCl-=mS=Vs×d×2.00/20.00
=2.00×1.189×2.00/20.00
=0.4328
21、KCl%=ms×25.00/50.00
=ms/2×100%
=0.5947/2×100%=73.33%

